LA oganesson, símbolo Og, número atómico 118, es el elemento químico con el número atómico más alto en la Tabla Periódica hasta el momento. No se encuentra en la naturaleza y su producción es artificial, por lo que se considera un elemento sintético. Aun así, su producción es muy difícil, y se considera un elemento muy raro, habiendo sido sintetizado muy pocas veces.
A pesar de estar en el mismo grupo que el Gases nobles, la oganesona no tiene muchas características que se refieran a estos elementos, según los cálculos demuestran los matemáticos, como consecuencia de los efectos relativistas que sufren los elementos superpesados.
El elemento 118 se sintetizó por primera vez en 2002, mediante la reacción de iones 48Ca con átomos de 249Ver Su nombre es un homenaje al científico ruso Yuri Oganessian, uno de los más respetados y reconocidos en el área de los elementos superpesados.
Vea también: Rutherfordio: el elemento químico sintético que lleva el nombre del científico Ernest Rutherford
Resumen sobre oganesson
La oganesona es un elemento químico sintético ubicado en el grupo 18 de la Tabla periodica.
Se sintetizó por primera vez en 2002, en un trabajo conjunto entre científicos rusos y estadounidenses.
Conforma el grupo de elementos incluidos más recientemente en la Tabla Periódica, en 2016.
Es un elemento muy raro, habiendo sido sintetizado muy pocas veces.
Sus estudios aún son muy recientes, y las propiedades básicas aún se determinan mediante cálculos y modelos matemáticos.
Pruebas teóricas preliminares indican que, a pesar de pertenecer al grupo de los gases nobles, algunas propiedades alejan a Og de los demás elementos.
La producción de oganesona ocurre por Fusión nuclear, utilizando iones de 48Ca y átomos de 249Ver
Su nombre es un homenaje al científico ruso Yuri Oganessian, uno de los más importantes en el campo del estudio de los elementos superpesados.
propiedades de oganesson
Símbolo: Oh
Número atómico: 118.
Masa atomica: 294 u.c. (no oficial por Iupac).
Configuración electrónica: [Rn] 7s2 5f14 6d10 7p6.
Isótopo más estable: 294Og (vida media de 0,69 milisegundos, que se puede aumentar en 0,64 milisegundos o reducir en 0,22 milisegundos).
Serie química: grupo 18, elementos superpesados, gases nobles.
Características del oganesón
Oganesson es el elemento de número atómico más alto (118) hecho oficial hasta ahora por la Unión Internacional de Química Pura y Aplicada (IUPAC). Aunque se produjo por primera vez en 2002, poco se sabe de el. Aún se especula mucho, ya que este elemento no se encuentra en la naturaleza. Su producción se realiza en el laboratorio, lo que lo configura como un elemento sintético.
Además, su media vida es menos de un milisegundo (10-3 segundo), recordando que la vida media es el tiempo requerido para que la cantidad se reduzca a la mitad. Por lo tanto, las propiedades que se le están estipulando a este elemento no son más que los resultados de cálculos teóricos basados en modelos matemáticos, porque en la región de la Tabla Periódica en la que se encuentra encuentra el efectos relativistas (la discrepancia entre los efectos esperados y observados como resultado de la relatividad) son significativos.
Los efectos relativistas alejan a Og de lo que se esperaba de él. El elemento, por ejemplo, no tiene un comportamiento similar a los gases nobles. Los cálculos muestran que la oganesona sería un sólido a temperatura ambiente, con un punto de fusión en el rango de 325 ± 15 K (alrededor de 52 °C) y un punto de ebullición en el rango de 450 ± 10 K (alrededor de 177 ºC).
También se sabe que el Og puede ser más reactivo que otros gases nobles, ya que los efectos relativistas le permiten perder electrones del subnivel p más fácilmente. Otro punto de desacuerdo con los gases nobles es que la oganesona es un semiconductor, mientras que los otros son aislantes.
Lea también: Hidrógeno: el elemento químico que tiene el número atómico más bajo en la tabla periódica
Obtención de oganesón
Al igual que otros elementos superpesados, el oganesón se obtiene mediante una técnica denominada fusión en caliente, donde los iones del isótopo 48Ca, que se encuentra naturalmente pero muy poco disponible, reacciona con isótopos mucho más pesados para producir los elementos superpesados.
Og es un elemento tan raro y difícil de obtener que En un lapso de diez años, sólo cuatro átomos llegó a ser producido. Básicamente, la producción de 294Og, el único isótopo conocido, se produce por bombardeo de iones 48Ca a un núcleo de 249Cf, con liberación de 3 neutrones.
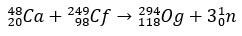
Con unos pocos milisegundos de vida media, el Og fue identificado a través de su patrón de descomposición, algo muy habitual en elementos superpesados. En este caso, se produjeron 3 desintegraciones alfa, provocando que el elemento 118 se convirtiera en copernicium, Cn, que, finalmente, sufrió una fisión espontánea.
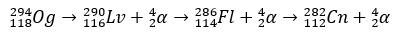
historia de oganesson
La primera síntesis de oganesona tuvo lugar en 2002., en la ciudad de Livermore, California, Estados Unidos, en el Laboratorio Nacional Lawrence Livermore, donde un grupo de científicos estadounidenses colaboró con investigadores rusos del célebre Instituto Conjunto de Investigaciones Nucleares (JINR), dirigido por el científico ruso Yuri Oganessian.
En un período de diez años desde la primera síntesis, solo se sintetizaron cuatro átomos de oganesona, debido a la rareza y dificultad de los parámetros de reacción. El cuarto y último átomo, sin embargo, presentó un descubrimiento increíble.
Los científicos estaban tratando de sintetizar el elemento 117 a través de la reacción de 48Ca con el 249Bk, sin embargo, se notó que el 28% del objetivo de berkelio sufrió una descomposición β, convirtiéndose en 249Cf y generando así el elemento 118. Es de destacar que el nombre del elemento 118 honra al científico ruso Yuri Oganessian, un homenaje que para los químicos vivos sólo se ha producido dos veces en la historia de la química, siendo la primera a Glenn Seaborg, con el seaborgio.
Ejercicios resueltos de oganesson
Pregunta 1
La oganesona, elemento de número atómico 118 y símbolo Og, se colocó en el séptimo período de la tabla periódica, en el grupo de los gases nobles. En consecuencia, mucho se ha especulado sobre si tal elemento presentaría una gran estabilidad, característica conocida por los demás elementos de este grupo. La asignación de Og en el grupo 18 se debió a:
A) este elemento es altamente estable.
B) este elemento tiene ocho electrones en su capa de valencia.
C) este elemento es demostrablemente un gas a temperatura ambiente.
D) este elemento tiene las mismas propiedades químicas que los demás gases nobles.
E) este elemento tiene una alta energía de ionización.
Resolución:
Alternativa B
La asignación de la Og se produce única y exclusivamente en razón de su distribución electrónica. El hecho de que tenga ocho electrones en capa de valencia, 7s2 7p6, lo pone en esa posición. Los estudios con este elemento aún son preliminares, pero ya se especula, por resultados matemáticos, que el Og no es un gas a temperatura ambiente, por ejemplo. Otro punto a destacar es que Og no es estable en absoluto, ni siquiera existe en la naturaleza.
Pregunta 2
La gran dificultad para producir el elemento 118 genera la idea de que los científicos estaban en una verdadera odisea para poder detectarlo. No es de extrañar, después de diez años de su primera síntesis, oganesson solo se sintetizó otras tres veces. Y hasta ahora, solo se conoce un isótopo, el 294Oh ¿Cuántos neutrones tiene el isótopo conocido de oganesson?
A) 294.
B) 118.
C) 176.
D) 412.
mi) 166.
Resolución:
Alternativa C
El número de neutrones de Og se puede calcular de la siguiente manera:
A = Z + norte
A es el número de pasta atómico, Z es el número de protones (o número atómico) y n es el número de neutrones. Sustituyendo los valores, tenemos:
294 = 118 + norte
n = 294 - 118
n = 176
Por Stefano Araújo Novais
Profesor de química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/oganessonio-og.htm
