EL isomería es un fenómeno que se observa cuando se forman diferentes compuestos por cantidades iguales de los mismos tipos de átomos.
Por tanto, podemos encontrar sustancias químicas con la misma fórmula molecular y diferentes fórmulas estructurales o arreglos espaciales.
Este fenómeno se observa ampliamente en Química Orgánica, que estudia los compuestos de carbono. Como cada átomo de este elemento puede formar 4 enlaces químicos, es posible observar diferentes combinaciones.
Dado que el cambio en la disposición de los átomos da lugar a nuevas sustancias, estas tienen propiedades físicas y químicas diferentes.
Cuando decimos qué compuestos son isómeros significa que tienen partes iguales, ya que la palabra es una combinación de dos términos de origen griego: isos, significa "realmente", y mero, que es "partes".
Los dos grupos principales de isomería son el plano y el espacial (estereoisomería).
EL isomería plana se puede visualizar mediante la fórmula estructural plana de los compuestos y tiene cinco clases: posición, función, cadena, compensación y tautomeria.
EL isomería espacial se observa por la orientación de los compuestos y se subdivide en geométrica (cis-trans) y óptica.
El concepto de isomería fue introducido en 1830 por el científico sueco Jacob Berzelius.
Ejemplos de isómeros
EL isomería de cadena Ocurre cuando el mismo conjunto de átomos se conectan para formar estructuras del mismo grupo funcional, pero con cadenas diferentes.
Ejemplo: la fórmula molecular C4H10 de un hidrocarburo puede ser lineal o ramificado.

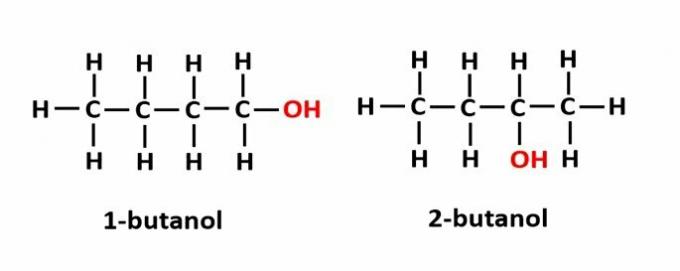
EL isomería de posición Ocurre cuando los compuestos están formados por los mismos grupos funcionales, pero se encuentran en diferentes posiciones de la cadena.
Ejemplo: la fórmula molecular C4H9OH corresponde a dos tipos de alcohol.
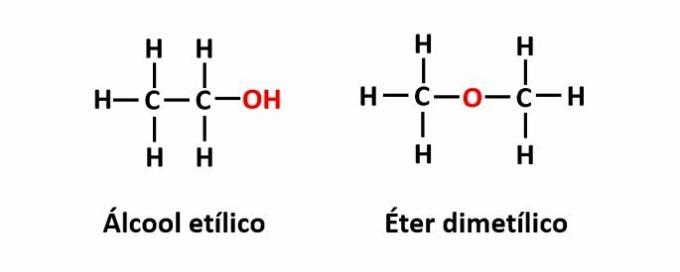
EL isomería de función ocurre cuando la misma fórmula molecular corresponde a dos compuestos con diferentes grupos funcionales.
Ejemplo: la fórmula molecular C2H6O corresponde a dos isómeros que tienen las funciones alcohol (-OH) y éter (-O-).
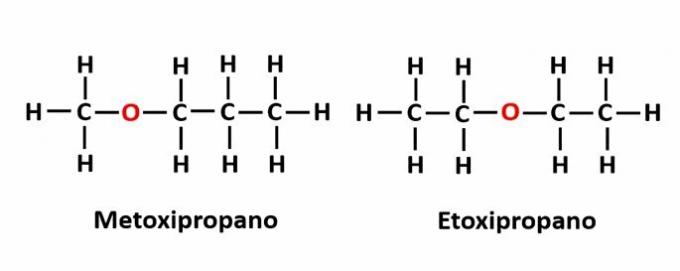
EL isomería de compensación ocurre cuando hay un heteroátomo en la cadena y ocupa diferentes posiciones. Este es un caso particular de isomería de posición.
Ejemplo: la fórmula molecular C4H10Indica la presencia de un átomo de oxígeno en la cadena, pero su posición puede cambiar y formar diferentes compuestos.
EL isomería dinámica, también llamado tautomery, ocurre cuando dos compuestos con funciones diferentes están en la misma solución en equilibrio dinámico. Este es un caso particular de isomería funcional.
Ejemplo: la fórmula molecular C2H4O corresponde a compuestos con funciones aldehído y enol.
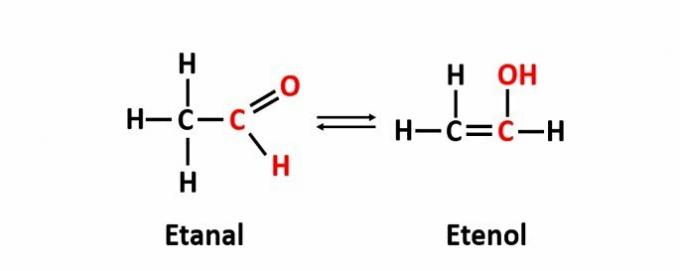
Aprender más acerca de isomería plana.
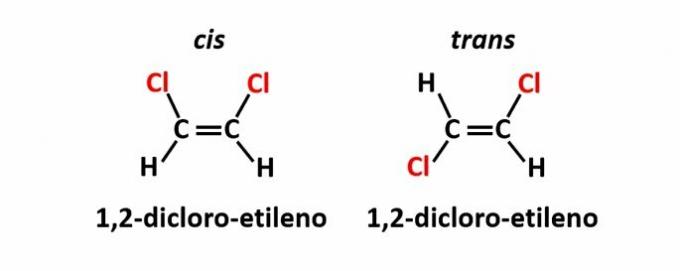
EL isomería geométrica, también llamado isomery cis-trans, ocurre cuando la presencia de un doble enlace o estructura cíclica hace que ligandos iguales estén en el mismo lado del plano (cis) o en lados opuestos (trans).
Ejemplo: los átomos de cloro en compuestos de fórmula molecular C2H2Cl2 pueden tener dos estructuras espaciales.
EL isomería óptica ocurre cuando, al desviar la luz polarizada emitida sobre la estructura, los compuestos logran desviar el haz luminoso a la izquierda, si es un isómero levógiro (l), oa la derecha, cuando es un isómero dextrorrotatorio (D).
Ejemplo: este tipo de isomería ocurre con el ácido láctico. Observe a continuación que las imágenes espectrales de los isómeros no se superponen, por lo que se denominan enantiómeros.
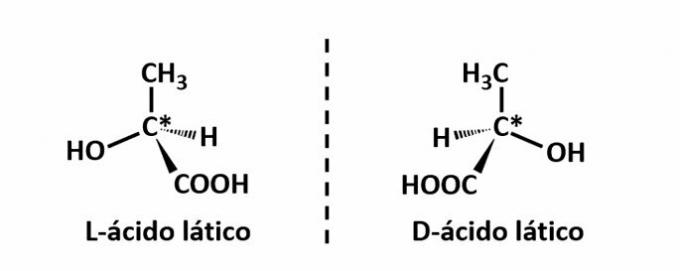
El símbolo C * indica la presencia de un carbono quiral en esta estructura, es decir, un átomo de carbono con 4 enlazadores diferentes.
Obtenga más información sobre la isomería con los contenidos:
- Tipos de isomería
- isómero espacial
- isómero geométrico
- isómero óptico
- Ejercicios sobre isomería de planos