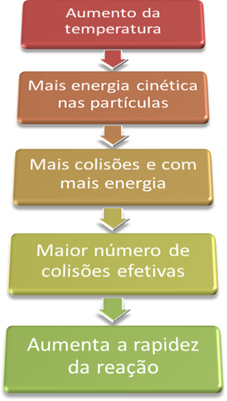
Cuanto mayor sea la temperatura, mayor será la velocidad de reacción.
Esto se puede ver fácilmente en muchas situaciones de nuestra vida diaria, como en los siguientes ejemplos:
- Cuando queremos ralentizar la reacción de descomposición de un alimento, bajamos la temperatura y lo colocamos en el frigorífico;

- Si queremos acelerar la reacción de cocción de los alimentos, simplemente póngalos en una olla. presión que, al aumentar la presión, también aumenta la temperatura de ebullición del agua líquida en la que la comida es;

- Los incendios, en general, suelen ser devastadores porque aumenta la temperatura del ambiente, lo que provoca un aumento en la velocidad de la reacción de combustión;
- Para ralentizar los procesos químicos metabólicos, disminuyendo las posibilidades de daño cerebral debido a deficiencia de oxígeno, algunas cirugías se realizan bajando la temperatura corporal del paciente, alcanzando alrededor 15 ° C;
- Si ponemos una tableta efervescente en un vaso de agua caliente y otra en un vaso de agua fría, la primera se disolverá mucho más rápido.
Pero, ¿qué explica la influencia directamente proporcional de la temperatura en la velocidad de reacción?
Esto se debe a que, como se explica en el texto "Condiciones para la aparición de reacciones químicas”, Para que se produzca una reacción, es necesario satisfacer algunas condiciones, como que las partículas deben chocar de manera efectiva y con la energía mínima requerida, lo que se denomina energía de activación.
Así, cuando aumentamos la temperatura del sistema, también aumentamos la agitación de las partículas que reaccionan y les proporcionamos más energía cinética. Con esto, se producirán más colisiones y con más energía, aumentando la cantidad de partículas que reaccionarán y, en consecuencia, aumentando la velocidad de reacción.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm