Como se indica en el texto "Ecuacion quimica”, Para representar reacciones químicas y comprender la forma en que se procesan, sus aspectos cuantitativos y cualitativos, se acordó utilizar ecuaciones químicas. Las ecuaciones químicas contienen símbolos y números que muestran qué sustancias están presentes y las proporciones adecuadas en las que reaccionan.
A través de la interpretación de estas ecuaciones, es posible encontrar datos importantes que nos ayuden a realizar cálculos estequiométricos. Sin embargo, el primer paso dice que la ecuación debe estar equilibrada, es decir, debe tener el número total de átomos de los reactivos igual al de los productos. Puede comprender cómo realizar este equilibrio a través del texto "Equilibrio de ecuaciones”.
Antes, sin embargo, comprenda algunos conceptos importantes en este caso, como el significado de los términos: índice, coeficiente estequiométrico y mol. Estos términos se explicarán a continuación y nos darán una mejor idea de la parte cuantitativa de la reacción:
- Índice: es el número que indica el número de átomos de cada elemento presente en fórmulas químicas. Este número aparece a la derecha del elemento en cuestión y aparece en subíndice, es decir, en un tamaño de letra más pequeño.
Ejemplo:
H2O (fórmula química de la sustancia acuosa)
Que significa:
- Los elementos que componen esta sustancia son H (hidrógeno) y O (oxígeno).
- El índice de cada elemento indica cuántos átomos de cada uno están presentes en la fórmula de la molécula de agua:
H2O → Índice O: solo hay 1 átomo de oxígeno.
↓
Índice H: indica que hay 2 átomos de hidrógeno.
Tenga en cuenta que en el caso del oxígeno no hay un número escrito, lo que significa que solo hay 1 átomo de ese elemento, como se explicó anteriormente.
Ahora bien, hay algunos casos en los que aparecen paréntesis en las fórmulas. ¿Cómo debemos interpretar esto? Vea el ejemplo a continuación:
Aquí3(POLVO4)2(fórmula química de la sustancia de fosfato de calcio)
- El contenido de Ca indica que hay 3 átomos del elemento calcio presentes en la fórmula química;
- El P (fósforo) y el O (oxígeno) están entre paréntesis, por lo que el índice que está afuera, que en este caso es 2, pertenece a ambos. Entonces, para saber cuántos átomos de cada uno hay en la fórmula, debe multiplicar sus índices por separado por el índice externo. Tenga en cuenta cómo se hace esto:

No pares ahora... Hay más después de la publicidad;)
P → índice 1 O → índice 4
P = 1. 2 O = 4. 2
P = 2 O = 8
Entonces hay 2 átomos de fósforo y 8 de oxígeno.
- Coeficiente estequiométrico: es el número que viene antes de la fórmula para indicar la cantidad de cada sustancia y la proporción de moléculas que participan en la reacción. Así, como en el caso del índice, cuando el coeficiente es igual a 1, no es necesario anotarlo, ya que está implícito.
Ejemplo:
2H2 + 1O2 → 2 H2O (esta reacción de formación de agua se muestra en la figura introductoria)
↓ ↓ ↓
Coeficientes de reacción
En esta ecuación, a través de los coeficientes, se muestra que dos moléculas de gas hidrógeno reaccionan con una de gas oxígeno, para formar dos moléculas de agua como producto. Por tanto, la relación estequiométrica de esta reacción es 2: 1: 2.
Para conocer el número total de átomos de cada elemento que están presentes en la reacción, es necesario multiplicar los coeficientes por los índices de cada elemento:
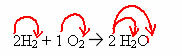
Reactivos:
H = 2. 2 = 4 átomos de hidrógeno
O = 1. 2 = 2 átomos de oxígeno
Producto:
H = 2. 2 = 4 átomos de hidrógeno
O = 1. 2 = 2 átomos de oxígeno
Tenga en cuenta que le dio la misma cantidad a los reactivos y a los productos, lo que significa que la reacción se equilibra correctamente.
- Mol (cantidad de materia):en una ecuación química, se considera que los coeficientes indican la cantidad de mol o la cantidad de materia. Entonces, en el caso anterior tenemos 2 moles de H2 reaccionando con 1 mol de O2, generando como productos 2 moles de H2O.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Términos cuantitativos en una ecuación química"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/termos-quantitativos-uma-equacao-quimica.htm. Consultado el 27 de julio de 2021.