Polimerización es el nombre del proceso químico que da como resultado la formación de macromoléculas (moléculas grandes) llamadas polímeros, a través de la combinación de moléculas más pequeñas, los monómeros.
la reacción de polimerización es muy común en la naturaleza, como podemos ver en los carbohidratos (como el almidón) y las proteínas (como la caseína en la leche). También se produce de forma sintética, ya que la gran mayoría de los polímeros que utiliza el ser humano en su vida diaria se elaboran de forma artificial.
El primer polímero producido a partir de polimerización La sintética fue la baquelita, en 1909, del químico belga Leo Hendrik Baekeland.
En general, para que un monómero se combine con otro (sean iguales o diferentes) en una reacción de polimerización, es necesaria la existencia de valencia libre (enlace químico a realizar) en ambos monómeros.
Estas valencias surgen como resultado de la rotura de enlaces, mediante el uso de catalizadores (como el níquel), condiciones externas como la luz y el calor, o por el fenómeno de resonancia en la estructura (desplazamiento de electrones).
En la formación de polipropileno (polímero PP), por ejemplo, utilizado en utensilios domésticos y juguetes, el enlace pi (π) en cada molécula se desglosa de la siguiente manera:
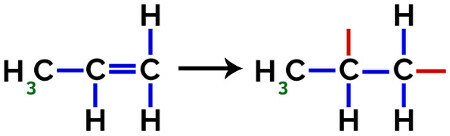
Rotura del enlace pi en propileno
Por tanto, cada monómero de propileno puede unirse con otros dos monómeros de propileno y formar el polímero PP o polipropileno (el prefijo poli indica varias unidades monoméricas). La forma más frecuente de representar un polímero tiene el monómero entre paréntesis y, en el exterior, la letra n, que indica varios monómeros, como podemos ver en el caso del polímero PP:
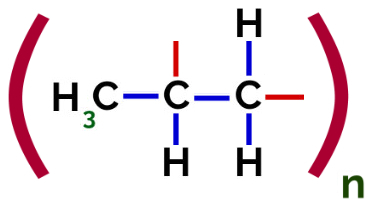
Representación de polímero PP
la reacción de polimerización se puede hacer de diferentes formas, como veremos a continuación:
a) Reacción de polimerización por adición
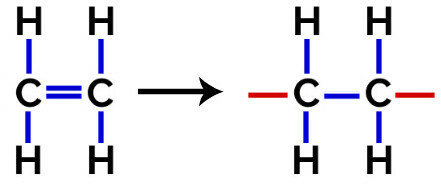
En esto polimerización, siempre hay una ruptura de un enlace pi en el monómero, lo que hace que aparezcan dos valencias libres en la estructura, como en la formación de la polietileno, polímero ampliamente utilizado en envases farmacéuticos.
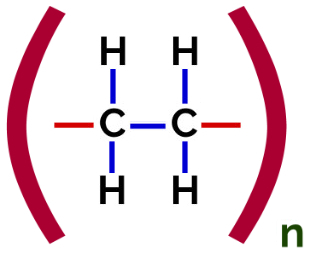
Fórmula estructural de polímero de adición de polietileno
A polimerización de polietileno, se utilizan como monómero moléculas de etileno (eteno), que tienen un enlace pi entre los dos átomos de carbono. Cuando este enlace se rompe, aparecen dos valencias libres, una en cada átomo de carbono que estaba involucrado en el enlace pi. Los monómeros se unen exactamente en cada una de estas valencias, es decir, la valencia de uno está ligada a la valencia del otro, y así sucesivamente.
Ecuación de formación de polietileno
b) Reacción de polimerización por adición 1.4
En esta polimerización, los monómeros presentan dos dobles enlaces alternos (uno pi y uno sigma), lo que favorece el fenómeno de resonancia (alternando la posición de los electrones pi del enlace pi), como en la formación de caucho sintético (polibutadieno)

Fórmula estructural de polibutadieno
La unidad monomérica de este polímero es el butadieno, que tiene dos dobles enlaces alternos. Con resonancia, la estructura tiene un doble enlace entre los carbonos 2 y 3, y dos valencias libres en los carbonos 1 y 4. Es precisamente en estas valencias libres de carbonos 1 y 4 donde se combinan los monómeros.

Resonancia de butadieno
c) Reacción de polimerización por condensación o eliminación
Es una reaccion de polimerización en el que, obligatoriamente, dos monómeros (iguales o diferentes) pierden simultáneamente átomos o grupos, dando lugar a dos valencias libres en cada uno de ellos. De esta forma, siempre existe la eliminación de hidrógeno de un monómero, que luego se une con un halógeno (F, Cl, Br, I), OH, NH2, o al CN del otro monómero.
Entonces, en el polimerización por eliminación, siempre se produce la formación de agua, ácido halogenado (HCl, HI, HF, HBr), amoniaco (NH3) o ácido cianhídrico (HCN) además del polímero. Véase, por ejemplo, la representación de la formación de poliéster, un material utilizado como tejido:

Ecuación de formación de poliéster
Los monómeros formadores de poliéster son ácido p-bencenodioico y etano-1,2-diol. Podemos observar que en este polimerización se produce la eliminación de las moléculas de agua, ya que los dos monómeros tienen dos hidroxilos. En este proceso, el ácido pierde los dos hidroxilos y el dialcohol pierde solo el hidrógeno de sus hidroxilos:

Estructura de poliéster
Los monómeros de poliéster están unidos por el oxígeno del alcohol y el carbono del ácido carboxílico.
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-polimerizacao.htm

