LOS pastaatómico, como sugiere su nombre, es la masa de un átomo, generalmente simbolizada por "mlos”O“ MA ”. Sin embargo, dado que el átomo es una entidad extremadamente pequeña, invisible a los ojos humanos, no es posible medir su masa usando escalas, por ejemplo. Entonces, los científicos determinaron la masa de los átomos comparándolos con las masas de otros átomos.
Esto también se hace con las otras unidades. Por ejemplo, la unidad de masa es el kilogramo estándar, que corresponde a un cilindro de 3.917 cm de altura y diámetro, fabricado con un 10% de iridio y un 90% de platino. Entonces sirve como comparación. Por ejemplo, si “pesamos” un objeto en una balanza y encontramos que su masa es de 10 kg, eso significa que su masa es 10 veces mayor que el estándar elegido: 1 kg.
Lo mismo se aplica a los átomos. El estándar elegido fue el carbono 12, y a este átomo se le asignó arbitrariamente una masa de 12 u. La "u" es la unidad de masa atómica y, por lo tanto, equivale a 1/12 de la masa de un átomo de carbono.
Por ejemplo, cuando decimos que la masa atómica del hidrógeno es igual a 1 u, significa que es como si si dividimos el carbono en 12 partes, la masa de una de estas partes es equivalente a la masa del átomo de hidrógeno. Otro ejemplo es el azufre, su masa atómica es 32 u, lo que significa que su masa es 32 veces mayor que 1/12 de la masa de 12C.
1 u = 1/12 de la masa de 1 átomo de carbono 12

La unidad de masa atómica es 1/12 de la masa del carbono-12.
La masa molecular de las sustancias es la suma de las masas atómicas de los elementos. Por ejemplo, la masa atómica del oxígeno es igual a 16 u, por lo que la masa molecular de la molécula de oxígeno gaseoso (O2) es igual a 32u.
Como las técnicas de laboratorio están actualmente muy avanzadas, existen dispositivos que miden con precisión la masa atómica de los elementos, como el espectrómetro de masas. Por tanto, es posible saber que 1 u es igual a 1,66054. 10-24 gramo.
Mapa mental: masa atómica

* Para descargar el mapa mental en PDF, Haga clic aquí!
Dado que las masas atómicas se determinan con gran precisión, se dan en la tabla periódica en forma de números decimales. Pero cuando vamos a hacer los cálculos, usualmente usamos el número redondeado, con la excepción de los experimentos que necesitan ser muy precisos. Por ejemplo, si observa la tabla periódica, verá que la masa atómica del oxígeno es igual a 15.999 u, pero generalmente usamos el valor 16 u en los cálculos. Esto también ocurre con el carbono, cuya masa atómica está dada por 12.01 u, como se muestra a continuación:
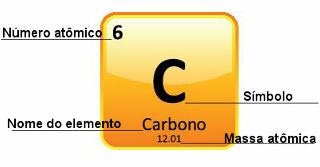
Representación del carbono en la tabla periódica
Los elementos que aparecen en la tabla periódica son en realidad el promedio ponderado de todos los isótopos naturales del elemento. Así, la masa atómica que aparece en la Tabla es también el promedio de las masas atómicas de estos elementos. Por ejemplo, el cloro (C?) Tiene dos isótopos naturales, 35 y 37, cuyos respectivos porcentajes en la naturaleza son 75,76% y 24,24%. Las masas atómicas de cada uno de estos isótopos son diferentes, siendo la de C? -35 34,96885 uy la de C? -37 de 36,96590.
De esta forma, la masa atómica del elemento se calcula teniendo en cuenta la masa de cada isótopo y la abundancia con la que aparece en la naturaleza. En el caso del cloro tenemos:
Masa atómica del elemento cloro = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Masa atómica del elemento cloro = 35,45
Este es el valor de masa atómica del cloro que aparece en la tabla periódica.
* Mapa mental de mí. Diogo Lopes
Por Jennifer Fogaça
Licenciada en Letras
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm

