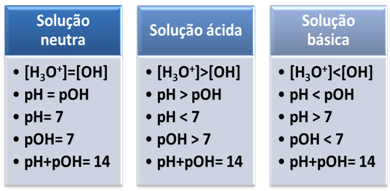
Un medio se considera neutro si tiene la misma concentración, en mol / L, de iones hidronio (H3O+) e hidróxido (OH-).
Un ejemplo de medio neutro que incluso sirve como estándar para otras soluciones es el agua pura destilada a una temperatura de 25ºC. A esta temperatura, tiene exactamente 1. 10-7 mol / L de ambos iones. Por lo tanto, su producto iónico (Kw) es igual a 10-14 (prostituta)2:
Kw = [H3O+]. [Oh-]
Kw = (1. 10-7 prostituta). (1. 10-7 mol / L) = 10-14 (prostituta)2
El pH y el pOH se dan a continuación:
pH = - log [H3O+] pOH = -log [OH-]
pH = - log 1. 10-7 pOH = - log 1. 10-7
pH = 7pOH = 7
Esto nos muestra que, en una solución neutra, la el pH es igual a pOH.
- Medio ácido:
En un medio ácido, la concentración de iones H3O+ es más grande que el de los iones OH-.
Esta solución se puede lograr agregando una pequeña parte de los iones H3O+, por ejemplo, mediante un ácido.
Según el principio de Le Chatelier, cuando se provoca una perturbación en un sistema en equilibrio, tiende a reajustarse para reducir los efectos de esta fuerza. Esto significa que si se agrega un ácido al agua, los iones H
3O+ estarán en exceso y el equilibrio se desplazará en la dirección de reacción inversa, hacia la izquierda. Entonces estos iones en exceso reaccionarán con los iones OH-. Por tanto, la concentración de iones OH- disminuirá y la solución se volverá ácida.
El producto iónico (Kw) siempre es igual a 10-14, pero la concentración de iones H3O+ es mayor que la concentración de iones OH-1. Por tanto, el pH es mayor que el pOH en un medio ácido, pero su suma siempre es igual a 14.
Además, cuanto mayor sea la concentración de iones H3O+, cuanto mayor sea el valor de pH. A temperatura ambiente (25 ° C), pH <7 y pOH> 7.

- Medios básicos:
En el medio básico, la concentración de iones OH- es más grande que el de los iones H3O+.
Si agregamos una base al agua, significa que estamos agregando iones OH.- y, como se explicó en el ítem anterior, por el principio de Le Chatelier, el equilibrio de la reacción de La autoionización del agua se moverá en la dirección opuesta, con iones en exceso reaccionando con Iones H3O+, disminuyendo su concentración y haciendo que la solución sea básica.
En ese caso, el pOH será mayor que el pH. A temperatura ambiente (25 ° C), pH> 7 y pOH <7.

Brevemente:
Por Jennifer Fogaça
Licenciada en Química
