se llama Modelo de Rutherford la propuesta hecha para el átomo por el científico Ernest Rutherford en 1911, con el objetivo de demostrar la forma y composición idealizadas del constituyente de la materia: el átomo.
O Modelo de Rutherford se lo conoce comúnmente como el modelo del sistema solar, ya que su estructura y funcionamiento se han comparado con la relación entre el sol y los planetas que giran a su alrededor.
En su modelo, Rutherford comparó el sol con el núcleo del átomo, y los electrones del átomo se compararon con los planetas del sistema solar, como se puede ver en la siguiente representación:
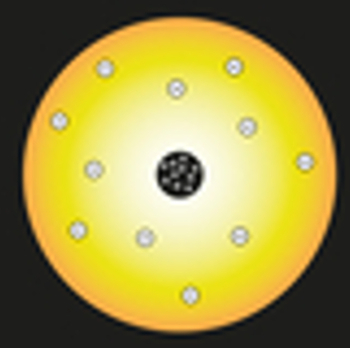
Representación del modelo atómico de Rutherford
Dentro del núcleo, se colocarían partículas cargadas positivamente, llamadas protones (descubiertas por Eugen Goldstein). Este núcleo sería pequeño y denso y tendría la mayor masa del átomo.
El experimento realizado por Rutherford
Todas las propuestas de Rutherford para la creación de su modelo atómico fueron el resultado de un experimento en el que enfocó haces de radiación alfa (originada en de polonio radiactivo presente en una caja de plomo) sobre una fina placa de oro, con una placa de metal cubierta de sulfuro de zinc por detrás y a los lados. lados. El sulfuro de zinc es una sal que, al recibir radiación, brilla.
Rutherford luego notó que tres puntos (a, b, c) en particular brillaron durante este experimento:
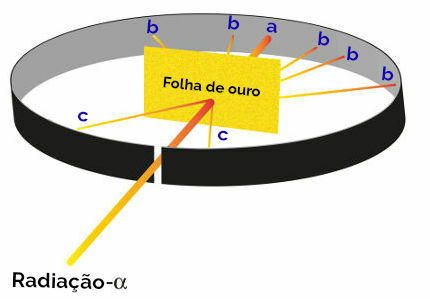
Representación del experimento de Rutherford
punto a (mayor incidencia de brillo): indicó que la radiación alfa atravesó la placa de oro sin ningún problema, ya que sería en la dirección del orificio de apertura del bloque de plomo;
punto b (pequeña incidencia de resplandor): indica que la radiación alfa atravesó la placa de oro, pero que se habría desviado durante el cruce;
punto c (una cantidad extremadamente pequeña de brillo): ubicado frente a la hoja de oro, indica que la radiación alfa no atravesó.
Rutherford atribuyó estos resultados observados a los átomos que forman la placa de oro, interpretando lo siguiente:
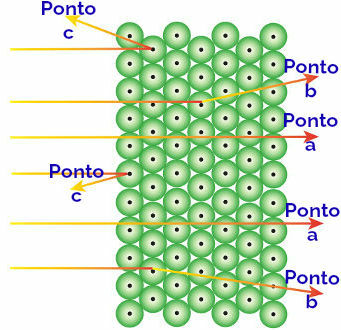
Representación del comportamiento de la radiación alfa y los átomos.
Radiación alfa que llega al apunta a: la radiación alfa es positiva y atraviesa una región del átomo de enormes espacios vacíos. También hay electrones presentes en algunos orbitales.
Radiación alfa que llega al punto b: la radiación alfa atraviesa los átomos de la placa de oro, pero llega a cierto momento en el que pasa cerca del pequeño núcleo del átomo, que está cargado positivamente, generando repulsión en el radiación.
Radiación alfa que llega al punto c: la radiación alfa atraviesa los átomos de la placa de oro, pero golpea un pequeño núcleo, que está cargado positivamente, generando repulsión en la radiación.
Problemática del modelo de Rutherford
Muchos físicos señalaron algunos problemas en el modelo propuesto por Rutherford:
1er problema: ¿cómo sería posible un núcleo cargado positivamente si las partículas cargadas positivamente se repelen entre sí?
2do problema: ¿por qué los electrones en las electrosferas no son atraídos por los protones en el núcleo?
3er problema: ¿por qué los electrones, que son pequeños cuerpos en constante movimiento, no pierden energía y caen en el núcleo?
* Créditos de imagen: Svic / Shutterstock
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-modelo-rutherford.htm
