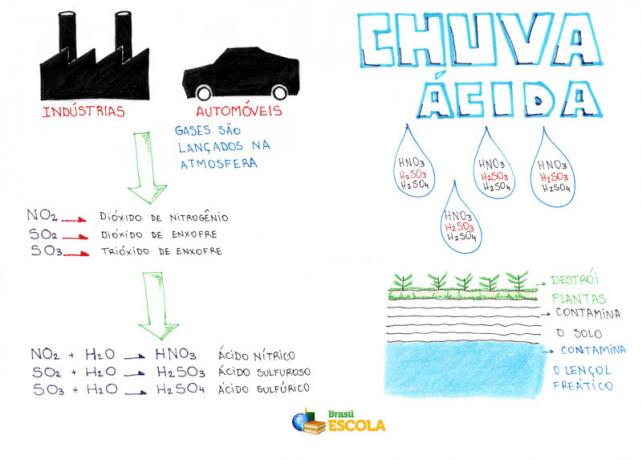
La lluvia ácida es producida por óxidos: Dióxido de azufre (SO2) y nitrógeno (NO2), ambos derivados de la quema de carbón, combustibles fósiles y contaminantes industriales.
SOLO2 y no2 luego se convierten en componentes de nuestra atmósfera. Y entonces surge el problema: estos gases, combinados con el hidrógeno presente en la atmósfera (vapor de agua), dan lugar a lluvias cargadas de ácido sulfúrico y ácido nítrico. Como puede verse, la presencia de estos ácidos es lo que acidifica la lluvia.
Cuando la lluvia ácida cae a la superficie, causa un gran impacto ambiental, altera la composición química del suelo y el agua, afecta las cadenas alimentarias y destruye bosques y cultivos. Además, causan daños no solo en el campo, sino también en las ciudades: corroen estructuras metálicas, monumentos históricos (estatuas) y edificios.
Conozcamos un poco más sobre la acción de estos ácidos:
→ ácido sulfúrico (H2SOLO4)
Este ácido puede destruir papel, tejidos de algodón, madera, azúcar y otros materiales debido a su acción energética (deshidratante). ¿Imagina el daño que causa cuando está presente bajo la lluvia?
El ácido sulfúrico tiene una acción corrosiva sobre los tejidos de los organismos vivos. Las lluvias formadas en un ambiente contaminado con dióxido de azufre contienen H2SOLO4, lo que provoca un gran impacto destructivo, debido a la propiedad de corroer plantas, metales e incluso piedras, como el mármol por ejemplo.
→ Ácido nítrico (HNO3)
La lluvia ácida producida en ambientes contaminados con óxido de nitrógeno (NO) contiene en su composición el ácido HNO3.
El ácido nítrico es tóxico y, como el ácido sulfúrico, es corrosivo y causa mucho daño a la naturaleza.
Mapa mental: lluvia ácida
* Para descargar el mapa mental en PDF, Haga clic aquí!
Por Líria Alves
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/quimica-chuva-acida.htm