La concentración común es la cantidad de soluto, en gramos, en 1 litro de solución.
Matemáticamente, la concentración común se expresa mediante:
1. (Mackenzie) ¿Cuál es la concentración, en g / L, de la solución obtenida al disolver 4 g de cloruro de sodio en 50 cm3 ¿de agua?
a) 200 g / L
b) 20 g / L
c) 0,08 g / L
d) 12,5 g / L
e) 80 g / L
Alternativa correcta: e) 80 g / L.
1er paso: Transforma la unidad de volumen de cm3 a L.
Sabiendo que 1 cm3 = 1 mL, entonces tenemos:
Paso 2: aplique los datos en la fórmula de concentración común:
2. (Mackenzie) Hay cinco recipientes que contienen soluciones acuosas de cloruro de sodio.
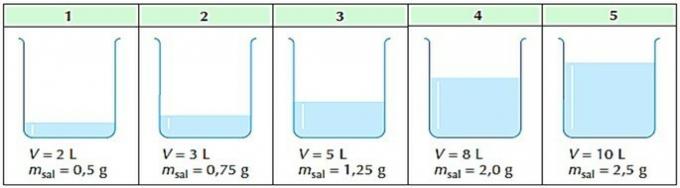
Es correcto decir que:
a) el recipiente 5 contiene la solución menos concentrada.
b) el recipiente 1 contiene la solución más concentrada.
c) solo los recipientes 3 y 4 contienen soluciones de igual concentración.
d) las cinco soluciones tienen la misma concentración.
e) el recipiente 5 contiene la solución más concentrada.
Alternativa correcta: d) las cinco soluciones tienen la misma concentración.
Aplicación de la fórmula de concentración común para cada uno de los contenedores, tenemos:
| 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|
De los cálculos realizados, vemos que todas las soluciones tienen la misma concentración.
3. (UFPI) La nueva legislación de tránsito establece un límite máximo de 6 decigramos de alcohol, C2H5OH, por litro de sangre del conductor (0,6 g / L). Considerando que el porcentaje promedio de alcohol ingerido que permanece en la sangre es del 15% en masa, identificar, para un adulto con un peso promedio de 70 kg. cuyo volumen de sangre es de 5 litros, el número máximo de latas de cerveza (volumen = 350 mL) ingeridas sin que el límite establecido sea anticuado. Información adicional: la cerveza tiene un 5% de alcohol por volumen y la densidad de alcohol es de 0,80 g / mL.
a 1
b) 2
c) 3
d) 4
e) 5
Alternativa correcta: a) 1.
Datos de la pregunta:
- Límite máximo permitido de alcohol en sangre: 0,6 g / L
- Porcentaje de alcohol ingerido que queda en sangre: 15%
- Volumen de sangre: 5 L
- Volumen de lata de cerveza: 350 mL
- Porcentaje de alcohol en la cerveza: 5%
- Densidad de alcohol: 0,80 g / mL
1er paso: Calcule la masa de alcohol en 5 L de sangre.
2do paso: Calcule la masa total de alcohol, ya que solo el 15% se absorbió en el torrente sanguíneo.
3er paso: Calcule el volumen de alcohol presente en la cerveza.
Paso 4: Calcula el volumen máximo de cerveza que se puede consumir.
5º paso: Interpretación de resultados.
El volumen máximo de cerveza que puede beber una persona para que la concentración de alcohol en sangre no supere los 0,6 g / L es de 500 ml.
Cada cerveza contiene 350 mL y al consumir dos latas, el volumen es de 700 mL, que supera el volumen establecido. Como tal, lo máximo que una persona puede ingerir es una.
4. (UNEB) El suero casero consta de una solución acuosa de cloruro de sodio (3,5 g / L) y sacarosa (11 g / L). Las masas de cloruro de sodio y sacarosa necesarias para preparar 500 ml de suero casero son, respectivamente:
a) 17,5 gy 55 g
b) 175 gy 550 g
c) 1750 mg y 5500 mg
d) 17,5 mg y 55 mg
e) 175 mg y 550 mg
Alternativa correcta: c) 1750 mg y 5500 mg.
Calcule la masa de cloruro de sodio
1er paso: Transforma la unidad de volumen de mL a L.
2do paso: Calcula la masa en gramos.
3er paso: Transforma el valor encontrado en miligramos.
Calcule la masa de sacarosa
1er paso: Calcula la masa en gramos.
Sabiendo que 500 mL = 0.5 L, entonces tenemos:
2do paso: Transforma el valor encontrado en miligramos.
a) 8.0
b) 6,0
c) 4.0
d) 2.0
e) 1.0
Alternativa correcta: d) 2.0.
1er paso: Transforma la unidad de volumen de mL a L.
2do paso: Calcule la masa de cloruro de magnesio (MgCl2).
a) 6.0. 101 kg
b) 6.0. 104 kg
c) 1.8. 102 kg
d) 2.4. 108 kg
e) 8.0. 106 kg
Alternativa correcta: a) 6.0. 101 kg.
1er paso: Calcula la masa de sales disueltas en el acuario.
Sabiendo que 1 L = 1000 mL = 1000 cm3, tenemos:
Paso 2: Transforma la unidad de masa de gramos a kilos.
3er paso: Transforma el resultado a notación científica.
Como número en notación científica tiene el formato N. 10No, para convertir 60 kg en notación científica "caminamos" con la coma y la colocamos entre 6 y 0.
Tenemos que N = 6.0 y como estamos caminando solo un lugar decimal, el valor de n es 1 y la respuesta correcta es: 6.0. 101 kg.
Respuesta correcta: 40 gotas.
Datos de la pregunta:
- Dosis analgésica recomendada: 3 mg / kg
- Cantidad de analgésico en gota: 5 mg de analgésico
- peso del paciente: 70 kg
1er paso: Calcular la cantidad de analgésico según el peso del paciente.
La cantidad calculada supera la dosis máxima. Por tanto, deben administrarse 200 mg, que corresponde al límite permitido.
2do paso: Calcule la cantidad de gota de analgésico.
8. (Enem) Una estación determinada trata unos 30 000 litros de agua por segundo. Para evitar el riesgo de fluorosis, la concentración máxima de fluoruros en esta agua no debe exceder aproximadamente 1,5 miligramos por litro de agua. La cantidad máxima de esta especie química que se puede utilizar con seguridad, en el volumen de agua tratada en una hora, en esta estación, es:
a) 1,5 kg
b) 4,5 kg
c) 96 kilogramos
d) 124 kg
e) 162 kg
Alternativa correcta: e) 162 kg.
Datos de la pregunta:
- Agua tratada: 30.000 L / s
- Concentración de fluoruro: 1,5 mg / L
1er paso: Transforma la hora en minutos.
2do paso: Calcule la masa de fluoruro en 30000 L / s.
3er paso: Calcule la masa para el tiempo de 1 h (3600 s).
Paso 4: Transforma la unidad de masa de mg a kg.
9. (UFRN) Uno de los potenciales económicos de Rio Grande do Norte es la producción de sal marina. El cloruro de sodio se obtiene del agua de mar en salinas construidas cerca de la costa. En general, el agua de mar viaja a través de varios tanques de cristalización hasta una concentración determinada. Suponga que, en uno de los pasos del proceso, un técnico tomó 3 muestras de 500 mL de un tanque de cristalización, llevó a cabo la evaporación con cada muestra y anotó la masa de sal resultante en la tabla a seguir:
| Muestra | Volumen de muestra (mL) | Masa de sal (g) |
|---|---|---|
| 1 | 500 | 22 |
| 2 | 500 | 20 |
| 3 | 500 | 24 |
La concentración media de las muestras será:
a) 48 g / L
b) 44 g / L
c) 42 g / L
d) 40 g / L
Alternativa correcta: b) 44 g / L.
1er paso: Transforma la unidad de volumen de mL a L.
Paso 2: aplique la fórmula de concentración común para cada una de las muestras.
| 1 | 2 | 3 |
|---|---|---|
3er paso: Calcule la concentración media.
10. (Fuvest) Considere dos latas de la misma soda, una en la versión “dietética” y la otra en la versión común. Ambos contienen el mismo volumen de líquido (300 mL) y tienen la misma masa cuando están vacíos. La composición del refrigerante es la misma en ambos, excepto por una diferencia: la versión común contiene un cierto cantidad de azúcar, mientras que la versión "dietética" no contiene azúcar (solo una masa insignificante de edulcorante artificial). Pesando dos latas de refresco cerradas, se obtuvieron los siguientes resultados:
| Muestra | Masa (g) |
|---|---|
| Lata con refresco regular | 331,2 g |
| Lata con refresco "dietético" | 316,2 g |
Con base en estos datos, se puede concluir que la concentración, en g / L, de azúcar en los refrescos regulares es aproximadamente:
a) 0,020
b) 0.050
c) 1.1
d) 20
e) 50
Alternativa correcta: e) 50.
1er paso: Calcula la masa de azúcar.
Como la única diferencia entre los refrescos es la masa de azúcar, ya que solo está presente en la versión común, podemos encontrarla restando las masas dadas de cada muestra.
2do paso: Transforma la unidad de volumen de mL a L.
3er paso: Calcule la concentración de azúcar.
Para obtener más conocimientos sobre soluciones químicas, consulte también estos textos.:
- Soluto y solvente
- Dilución de soluciones
- Molaridad
- Molalidad

