Fórmula estructural es el esquema que indica la estructura, es decir, la disposición de los átomos que componen los elementos químicos, así como la conexión entre ellos. Se puede representar de diferentes formas: plana, condensada o electrónica.
Entre los factores que condicionan las estructuras utilizadas, el número de electrones en la capa de valencia es uno de ellos.
Fórmula plana
La fórmula plana usa guiones para representar enlaces covalentes, que pueden ser simples, dobles o triples y representados de las siguientes maneras:
- conexión simple (cuando se comparten 2 electrones)
= doble enlace (cuando se comparten 4 electrones)
≡ triple enlace (cuando se comparten 6 electrones)
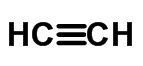
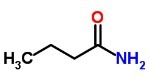
Fórmula condensada o simplificada
En la fórmula estructural condensada no se muestran los enlaces.
En su representación, el número de átomos de cada elemento se indica de forma condensada, es decir, simplificada:
H3C CH2 la CH2 CH3
Fórmula lineal condensada
La fórmula lineal condensada utiliza líneas en zigzag, en cuyos vértices se representan los carbonos:
Fórmula electrónica o de Lewis
La fórmula electrónica, también llamada fórmula de Lewis, está representada por puntos.
A través de estos puntos se muestran las cantidades de electrones presentes en las capas de valencia:
S.S
¿Y la fórmula molecular?
LA fórmula molecular, sin hacer referencia a su estructura, indica el número de elementos que componen una molécula. Además de indicar el número de átomos presentes en cada elemento y sus proporciones.
Se puede obtener mediante la fórmula mínima o empírica y la fórmula porcentual o centesimal.
Leer tambien Isomería y Capa de Valencia.
Ejercicios resueltos
1. (Vunesp-2000) Escriba la fórmula estructural y dé el nombre oficial:
a) una cetona saturada de cadena de carbono ramificada con un total de 7 átomos de carbono.
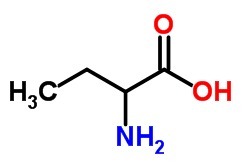
b) un aminoácido, con 4 átomos de carbono.
La)

B)
2. (FGV-2005) El aspartamo es un edulcorante artificial que fue descubierto accidentalmente en 1965 por un químico descuidado, que se lamió los dedos sucios y sintió que eran dulces.
No se recomiendan estos hábitos antihigiénicos, ya que muchas sustancias en cantidades mínimas son altamente tóxicas.
La fórmula estructural del aspartamo se muestra a continuación:

De la fórmula estructural del aspartamo, parece que hay
a) 13 átomos de carbono por molécula.
b) 1 grupo funcional éter.
c) 1 dipéptido
d) 2 átomos de carbono terciarios
e) solo 1 átomo de carbono asimétrico.
Alternativa c: 1 dipéptido
Para seguir probando sus conocimientos, consulte también estas listas de ejercicios:
- Ejercicios sobre hidrocarburos
- Ejercicios de química orgánica
- Ejercicios de isomería plana


