O Diagrama de fases es un gráfico que permite definir en qué estado físico se encuentra una sustancia en un momento dado, conociendo su temperatura y presión.
Las mediciones de laboratorio se utilizan para construir el diagrama de fases de una sustancia determinada.
El diagrama se divide en tres regiones, que representan el estado sólido, líquido y vapor.
Los puntos en las líneas que delimitan estas regiones indican los valores de temperatura y presión que puede tener la sustancia en dos estados.
Un diagrama de fases tiene los siguientes elementos:
- curva de Fusión: separa las áreas correspondientes a los estados sólido y líquido.
- curva de vaporización: separa las áreas correspondientes a las fases líquida y vapor.
- curva de sublimación: separa las áreas correspondientes a las fases sólida y vapor.
- triple punto: punto de intersección de las tres curvas (fusión, vaporización y sublimación). Este punto indica los valores de temperatura y presión que la sustancia puede tener simultáneamente en los tres estados.
- Punto crítico: indica la temperatura más alta a la que la sustancia es vapor. A partir de ese momento, ya no es posible diferenciar entre estados líquido y vapor. A temperaturas superiores al punto crítico, la sustancia se convierte en gas.
En la siguiente figura, presentamos una representación de un diagrama de fases:

Lea mas en: Cambios de estado físico.
curva de fusión
Las sustancias, en general, aumentan de volumen cuando se fusionan y, por el contrario, disminuyen de volumen cuando se solidifican. Como consecuencia, un aumento de presión conduce a un aumento del punto de fusión (temperatura de fusión).
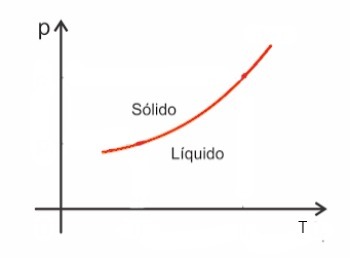
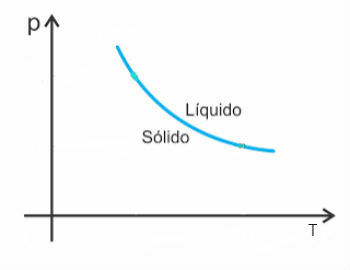
Sin embargo, existen algunas excepciones entre ellas el agua, que al fundirse disminuyen de volumen. En este caso, un aumento de presión provoca una disminución del punto de fusión.
Por lo tanto, la curva de fusión de estas sustancias se verá así:
Ejemplo
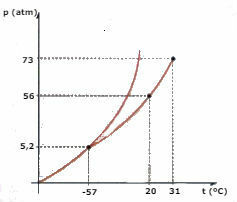
Considere el diagrama de fase de CO2 (dióxido de carbono) representado a continuación y responda las preguntas:
a) ¿Qué fase es el CO2 , cuando su temperatura es de -60 ° C y la presión es de 50 atm?
b) Una cierta cantidad de CO2 El líquido se somete a una presión de 56 atm y se confina en un recipiente. Si el líquido se calienta, manteniendo la presión constante, ¿cuál es el valor de temperatura al que se producirá la vaporización?
c) ¿Cuál es el valor de temperatura y presión del punto triple de CO2?
d) Un trozo de hielo seco (CO2) se somete a una presión de 2 atm. Se calienta manteniendo una presión constante. En un momento determinado comienza a producirse un cambio de fase. ¿Cuál es el nombre de este cambio?
Resolución:
a) Observando el diagrama, concluimos que el CO2 estará en la fase sólida.
b) La vaporización se producirá cuando la temperatura alcance los 20 ° C.
c) El punto triple corresponde a la intersección de las tres curvas, en el caso de CO2, cuando tiene una temperatura de -57 ° C y una presión de 5.2 atm, los tres estados físicos pueden coexistir.
d) Se producirá la sublimación
Para obtener más información, lea también:
- Solidificación
- Punto de fusión y ebullición
- Evaporación
- Condensación
Ejercicios resueltos
1) Enem - 2000
Incluso hoy en día, es muy común que las personas utilicen recipientes de barro (jarras o vasijas de cerámica sin esmaltar) para conservar el agua a una temperatura inferior a la del medio ambiente. Esto es porque:
a) la arcilla aísla el agua del medio, manteniéndola siempre a una temperatura más baja que la propia, como si fuera poliestireno.
b) la arcilla tiene el poder de "congelar" el agua debido a su composición química. En la reacción, el agua pierde calor.
c) la arcilla es porosa, permitiendo que el agua pase a través de ella. Parte de esta agua se evapora tomando calor de la moringa y el resto del agua, que luego se enfría.
d) la arcilla es porosa, lo que permite que el agua se asiente en el exterior de la jarra. El agua exterior está siempre a una temperatura más alta que la interior.
e) Moringa es una especie de refrigerador natural, liberando sustancias higroscópicas que reducen naturalmente la temperatura del agua.
Alternativa c: la arcilla es porosa, lo que permite el paso del agua. Parte de esta agua se evapora tomando calor de la moringa y el resto del agua, que luego se enfría.
2) Ita - 2013
Considere el diagrama de fases hipotético representado esquemáticamente en la siguiente figura:

¿Qué representan los puntos A, B, C, D y E?
punto A: punto de sublimación
punto B: punto triple
Punto C: punto de fusión / solidificación
punto D: punto de vaporización / condensación
punto E: punto crítico
3) UECE - 2009
Observe el diagrama de fases del PT que se muestra a continuación. Se puede concluir, correctamente, que una sustancia que ha pasado por el proceso de sublimación sigue la trayectoria:

a) X o Y
b) Y o U
c) U o V
d) T o X
Alternativa b: Y o U



