Una sustancia pura está formada por un solo tipo de especie química, es decir, su composición y propiedades son fijas. Una mezcla contiene más de un tipo de componente, por lo que su organización varía.
Por lo tanto, solo podemos distinguir una sustancia pura de una mezcla cuando conocemos su composición.
Al comparar un vaso de agua y un vaso de azúcar disuelto, nuestros ojos no notan ninguna diferencia. Sin embargo, si ingerimos el contenido de los dos vasos notaremos que uno es la sustancia pura y el otro está compuesto por una mezcla.
sustancias puras
Una sustancia pura es el conjunto de una sola especie química, es decir, no se mezcla con otras.
Usemos el agua como ejemplo. El agua (H2O) es reconocido por sus características y las propiedades específicas de este material nos ayudan a identificarlo. Las principales propiedades del agua ellos son:
| Densidad | 1,00 g / cm3 |
|---|---|
| Punto de fusión | 0 ° C |
| Punto de ebullición | 100 ° C |
Cuando un material tiene propiedades fijas e invariables en su totalidad, decimos que es un Sustancia pura.
Cuando ponemos sal de mesa, cloruro de sodio (NaCl), en un vaso de agua y lo agitamos, ocurrirá un cambio.

El resultado es un producto con una densidad intermedia entre la del agua y la sal. Esto se debe a que el agua ya no es una sustancia pura y se ha convertido en un Mezcla.
Al intentar congelar esta mezcla, notará que la temperatura de fusión será inferior a 0 ° C y que Además, esta mezcla no hervirá a 100 ° C, se necesitará más calor para evaporar esta producto.
Sustancias puras simples y compuestas
Las sustancias puras se clasifican como simples cuando en su composición hay átomos de un solo elemento químico.
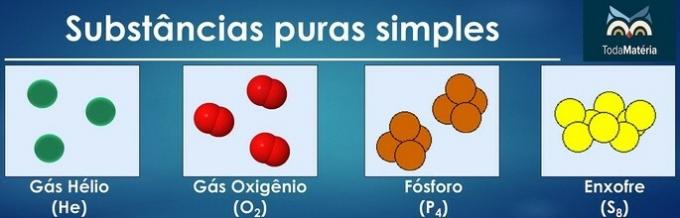
La disposición de los átomos de dos o más elementos químicos forma sustancias compuestas puras.

Mezclas
Una mezcla corresponde a la unión de dos o más sustancias puras, que se denominan componentes.
A diferencia de las sustancias puras, sus propiedades no son fijas ya que dependen de la proporción de componentes en la mezcla.
Vea cómo la densidad, una propiedad física, varía con la cantidad de sal mezclada con agua.
| Porcentaje de sal en masa total de mezcla |
Densidad de la mezcla (g / cm3) a 20 ° C |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Fuente: FURNISS, B. S. et al. Libro de texto de Vogel's de química orgánica práctica. 4. ed. Londres: Longman, 1987. pag. 1.312.
Por tanto, la adición de agua y sal, en cualquier proporción, tiene una densidad variable y, por tanto, no podemos clasificar la mezcla como agua o sal.
Mezclas homogéneas y heterogéneas
Las mezclas homogéneas son aquellas que presentan los componentes en una sola fase y, por tanto, las mismas propiedades en todos los puntos.

Cuando percibimos visualmente más de una fase, entonces la mezcla se clasifica como heterogénea.

Resumen de sustancias y mezclas puras
| Sustancias y mezclas puras | |
|---|---|
|
sistema homogéneo (solo una fase) |
Sustancia pura (un componente) |
|
mezcla homogénea (más de un componente en la misma fase) | |
|
sistema heterogéneo (más de una fase) |
Sustancia pura (un componente en diferentes estados físicos) |
|
mezcla heterogénea (más de un componente en más de una fase) |
Para obtener más información, asegúrese de consultar estos textos:
- Átomos
- Elementos químicos
- Separación de mezclas
Ejercicios con comentarios comentados
1. (UFMG) A una muestra de una sustancia pura X se le determinaron algunas de sus propiedades. Todas las alternativas tienen propiedades que son útiles para identificar esta sustancia, excepto:
a) densidad.
b) masa de la muestra.
c) solubilidad en agua.
d) temperatura de ebullición.
e) temperatura de fusión.
Alternativa incorrecta: b) masa de muestra.
a) CORRECTO. La densidad es la cantidad de materia en un volumen dado. Como propiedad específica del material, es útil para identificar una sustancia.
b) INCORRECTO. La masa es la cantidad de materia en un cuerpo. Como esta propiedad se aplica a cualquier materia, independientemente de su constitución, no es posible utilizarla para identificar una sustancia.
c) CORRECTO. La solubilidad es la capacidad de una sustancia para disolverse, o no, en un líquido determinado. Como propiedad específica del material, es útil para identificar una sustancia.
d) CORRECTO. La temperatura de ebullición corresponde a la temperatura de cambio de estado líquido a gaseoso. Como propiedad específica del material, es útil para identificar una sustancia.
e) CORRECTO. La temperatura de fusión corresponde a la temperatura de cambio de estado líquido a sólido. Como propiedad específica del material, es útil para identificar una sustancia.
2. (Vunesp) La etiqueta de una botella de agua mineral se reproduce a continuación.
| Composición química probable: |
|---|
| Sulfato de calcio 0,0038 mg / L |
| Bicarbonato de calcio 0.0167 mg / L |
Con base en esta información, podemos clasificar el agua mineral como:
a) sustancia pura.
b) sustancia simple.
c) mezcla heterogénea.
d) mezcla homogénea.
e) suspensión coloidal.
Alternativa correcta: d) mezcla homogénea.
un error. El agua sería pura si su composición solo tuviera moléculas de H2O.
b) INCORRECTO. Una sustancia simple está formada por átomos de un solo elemento químico. El agua pura tampoco es una sustancia simple, ya que está formada por átomos de hidrógeno y oxígeno (H2O) se clasifica como compuesto.
c) INCORRECTO. Una mezcla heterogénea tiene más de una fase, en cuyo caso solo podemos observar agua.
d) CORRECTO. Al tener una sola fase, el sistema es homogéneo. Al mirar la botella de agua, solo podemos ver el líquido, ya que los compuestos de sulfato de calcio y bicarbonato de calcio son solubles en agua y, por lo tanto, se disuelven.
e) INCORRECTO. Una suspensión coloidal es una mezcla heterogénea cuyos componentes se diferencian al microscopio.
3. (UCDB) En un laboratorio de Química se prepararon las siguientes mezclas:
I. agua / gasolina
II. agua / sal
III. agua / arena
IV. gasolina / sal
V. gasolina / arena
¿Cuáles de estas mezclas son homogéneas?
a) Ninguno.
b) Solo II.
c) II y III.
d) I y II.
e) II y IV.
Alternativa correcta: b) Solo II.
un error. El agua es un compuesto inorgánico y la gasolina un compuesto orgánico. Estas sustancias no tienen la capacidad de interactuar y debido a que tienen diferentes densidades forman una mezcla heterogénea.
b) CORRECTO. La sal, cloruro de sodio, se disuelve en agua formando una solución, que es una mezcla homogénea.
c) INCORRECTO. La arena, el dióxido de silicio, forma una mezcla heterogénea con el agua.
d) INCORRECTO. La sal es un compuesto inorgánico y la gasolina un compuesto orgánico. Estas sustancias no tienen la capacidad de interactuar y debido a que tienen diferentes densidades forman una mezcla heterogénea.
e) INCORRECTO. La arena es un compuesto inorgánico y la gasolina un compuesto orgánico. Estas sustancias no tienen la capacidad de interactuar y, por lo tanto, forman una mezcla heterogénea.
4. (Ufes) En un sistema bien mezclado que consta de arena, sal, azúcar, agua y gasolina, el número de fases es:
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
Alternativa correcta: b) 3.
FASE 1: La sal y el azúcar son capaces de interactuar con el agua y mediante fuerzas intermoleculares las moléculas se unen y forman una solución, que es una mezcla homogénea.
FASE 2: El agua es un compuesto inorgánico y la gasolina un compuesto orgánico. Estas sustancias no tienen la capacidad de interactuar y debido a que tienen diferentes densidades forman una mezcla heterogénea.
FASE 3: La arena es un silicato que no tiene afinidad química con el agua y la gasolina y, por tanto, representa una fase.
5. (Mackenzie) La mezcla formada por:
a) cubitos de hielo y solución acuosa de azúcar (glucosa).
b) N gases2 y compañía2.
c) agua y acetona.
d) agua y jarabe de grosella.
e) queroseno y gasoil.
Alternativa correcta: a) cubitos de hielo y solución acuosa de azúcar (glucosa).
a) CORRECTO. Es posible observar dos fases: los cubitos de hielo y la solución de glucosa, por lo que son un sistema heterogéneo.
b) INCORRECTO. Los gases son siempre una mezcla homogénea.
c) INCORRECTO. Se forman enlaces de hidrógeno entre el carbonilo de la propanona y la molécula de agua. Como son sustancias polares, la acetona es capaz de solubilizarse en agua y formar una mezcla homogénea.
d) INCORRECTO. Estos dos componentes se mezclan para formar un sistema homogéneo, ya que solo veremos un líquido rojo del jarabe de grosella, ya que se produce una dilución al agregar agua.
e) INCORRECTO. Ambos son compuestos orgánicos y por afinidad química forman una sola fase, lo que representa un sistema homogéneo.
Pon a prueba tus conocimientos con los ejercicios:
- Ejercicios sobre mezclas homogéneas y heterogéneas.
- Ejercicios de separación de mezclas.
- Ejercicios sobre propiedades de la materia.