Puede suceder que haya ácidos de un mismo elemento, y este elemento tenga el mismo número de oxidación (NOX), pero la diferencia está en los grados de hidratación.
Por ejemplo, a continuación, tenemos tres ácidos formados por el elemento fósforo (P):
H3POLVO4 H4PAG2O7 HPO3
Tenga en cuenta que en los tres ácidos el número de oxidación del fósforo es +5; la diferencia está en el grado de hidratación.
En base a esto, estos ácidos se diferencian en la nomenclatura mediante los prefijos orto, pyro y meta.
El ácido más hidratado se llama orto.. En el ejemplo dado, el primero (H3POLVO4) se llama ácido ortofosfórico, porque es el más hidratado de los tres. El prefijo orto es prescindible, por lo que la mayoría de las veces este ácido simplemente se llamará ácido fosfórico.
Los prefijos pyro y meta se utilizan con ortoácido como punto de referencia:
- Pyrus: 2 moléculas de orto menos 1 molécula de H2O
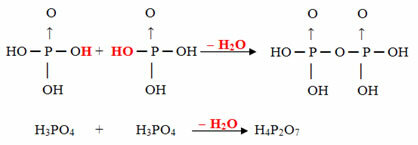
Ejemplo: la H4PAG2O7 se llama ácido pirofosfórico porque es igual a dos moléculas de ácido ortofosfórico (H3POLVO4) menos una molécula de agua.
2. H3POLVO4 = H6PAG2O8
H6PAG2O8 - H2O = H4PAG2O7
Este proceso es un deshidratación intermolecular:
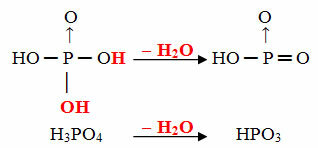
- Objetivo: 1 molécula de orto menos 1 molécula de H2O
Ejemplo: la HPO3 se llama ácido objetivofosfórico porque es igual a una molécula de ácido ortofosfórico (H3POLVO4) menos una molécula de agua.
H3POLVO4 - H2O = HPO3
Este proceso es un deshidratación intramolecular:
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm
