Una de las formas en que se organizan los elementos químicos es a través de familias, que corresponden a las secuencias verticales de la tabla periódica.
A 18 columnas de la tabla agrupan los elementos según similitudes en las propiedades químicas.
La organización de los elementos químicos en familias fue una forma práctica de estructurar las diversas informaciones encontradas y presentarlas de forma sencilla.
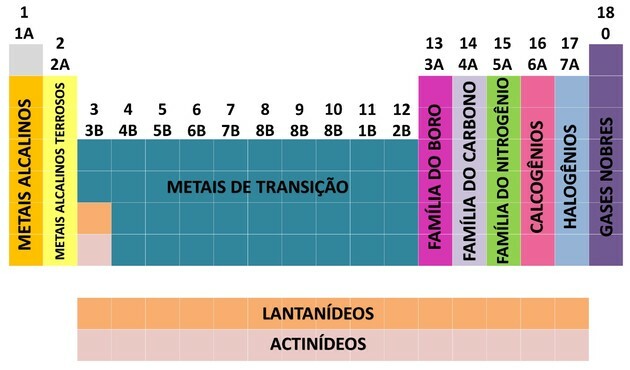
Para facilitar la ubicación de un elemento químico, las familias se designaron en números del 1 al 18 de la siguiente manera:
A través de la contribución de muchos científicos y varios intentos de ordenar los datos, la tabla periódica evolucionó, estableciendo un orden para ordenar los elementos.
Nomenclatura de familias
- Las familias de la tabla se dividieron en A (representativas) y B (transición), identificadas por letras y números.
- Tú elementos representativos las familias 0, 1A, 2A, 3A, 4A, 5A, 6A y 7A corresponden.
- Tú elementos de transición las familias 1B, 2B, 3B, 4B, 5B, 6B, 7B y 8B corresponden.
- Por determinación de la Unión Internacional de Química Pura y Aplicada (IUPAC), las familias fueron identificadas en grupos de 1 a 18.
Tabla periódica y distribución electrónica
Las similitudes entre los elementos de la misma familia se producen porque el número de electrones de valencia del átomo en el estado fundamental es el mismo para los miembros de un determinado grupo.
Por ejemplo:
| Grupo 1 | Distribución electrónica |
|---|---|
| 3leer | 2-1 |
| 11A | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87P. | 2-8-18-32-18-8-1 |
Los átomos del grupo 1 tienen sus electrones distribuidos en más de un nivel de energía, pero todos tienen un electrón de valencia.
Con eso, observamos que al hacer el distribución electrónica del átomo en el estado fundamental, encontramos su posición en la tabla periódica.
elementos representativos
Los elementos representativos exhiben un comportamiento químico relativamente menos complejo que los elementos de transición y forman la mayoría de las sustancias que nos rodean.
Algunas de las familias de elementos representativas reciben nombres especiales, como se muestra a continuación:
Grupo |
Familia | nombre especifico | Origen del nombre | Elementos | Configuración electrónica |
|---|---|---|---|---|---|
| 1 | 1A | Metales alcalinos | del latín álcali, que significa "gris de las plantas". | Li, Na, K, Rb, Cs y Fr | nosotros1 |
| 2 | 2A | metales alcalinotérreos | El término "terrenal" se refiere a "existir en la tierra". | Be, Mg, Ca, Sr, Ba y Ra | nosotros2 |
| 13 | 3A | familia de boro | Nombre del primer elemento de la familia. | B, Al, Ga, In, Tl y Nh. | nosotros2notario público1 |
| 14 | 4A | familia de carbono | Nombre del primer elemento de la familia. | C, Si, Ge, Sn, Pb y Fl. | nosotros2notario público2 |
| 15 | 5A | Familia de nitrógeno | Nombre del primer elemento de la familia. | N, P, As, Sb, Bi y Mc. | nosotros2notario público3 |
| 16 | 6A | Calcógenos | del griego khalks, ya que son elementos que se encuentran en los minerales de cobre. | O, S, Se, Te, Po y Lv. | nosotros2notario público4 |
| 17 | 7A | Halógenos | Expresión griega que significa formadores de sal. | F, Cl, Br, I, At y Ts. | nosotros2notario público5 |
| 18 | 0 | Gases nobles | Se consideró que no reaccionaba con otras sustancias. | Él, Ne, Ar, Kr, Xe, Re y Og. | 1 s2 (El) o nosotros2notario público6 |
A través de la tabla, podemos ver que:
- Los elementos presentados anteriormente se clasifican como representativos porque tienen el electrón más energético en un subnivel so p.
- Los electrones se distribuyen en niveles de energía y n representa el nivel más externo del átomo en el estado fundamental.
- Los elementos representativos, según recomendación de la IUPAC, pertenecen a los grupos o familias 1,2,13,14,15,16,17 y 18.
O hidrógeno se clasifica aparte de los demás elementos. Incluso con configuración electrónica 1s1, no forma parte del grupo 1 por presentar un comportamiento singular.
elementos de transición
Los elementos de transición corresponden a los grupos 3 a 12. Reciben este nombre porque tienen características intermedias entre los grupos 1 y 2 y los elementos no metálicos representativos.
Tú metales de transición están definidos por la IUPAC como:
Un elemento de transición tiene un subnivel d incompleto o puede formar cationes con un subnivel d incompleto.
Cuando el electrón más energético del átomo en estado fundamental está en un subnivel d incompleto, se caracteriza como una transición externa.
Los lantánidos y actínidos son elementos de transición internos ya que tienen al menos un subnivel f incompleto.
Cuando los elementos tienen electrones que llenan los orbitales dof, exhiben propiedades similares y pueden clasificarse en elementos orbitales dof. transición exterior o interior.
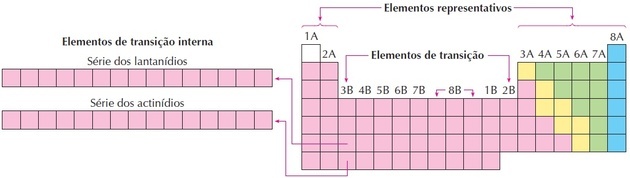
Como podemos ver en la imagen, la familia 8B corresponde a 3 columnas, son los grupos 8, 9 y 10, que se agruparon así porque tienen características similares.
Principales características de las familias
La siguiente tabla muestra las principales propiedades de los grupos en la tabla periódica:
| Grupo | Características | sustancias compuestas más común |
ocurrencias |
|---|---|---|---|
| 1 | Sólido y brillante en condiciones ambientales. Muy reactivo, blando y buenos conductores de electricidad. | Sales, hidróxidos y óxidos |
Reacciona con halógenos y forma sales. |
| 2 | Menos reactivo y más duro que el grupo 1. Sólidos de plata con buena conductividad. | Sales, hidróxidos y óxidos |
Formando sales y óxidos. |
| 3 hasta 12 | Forman complejos. Son sólidos metálicos, duros y quebradizos, a excepción del mercurio, que es líquido. | Sales, óxidos y complejos. Ej: AgNO3, TiO y [Cr (OH)3(H2O)3] |
En minerales en forma de óxidos. |
| 13 | Sólidos en condiciones ambientales, plata, excepto boro. | Óxidos Ej: B2O3 |
En minerales en forma de óxidos. |
| 14 | Sólido en condiciones ambientales. | Los átomos de C y Si pueden organizarse en cadenas y producir una gran variedad de sustancias. | En organismos vivos y en forma de silicatos u óxidos. |
| 15 | Sólidos, excepto nitrógeno, que es gaseoso en condiciones ambientales. | Óxidos y ácidos Ej: NO2 y H3POLVO4 |
Atmósfera, organismos vivos y minerales. |
| 16 | Sólidos, excepto oxígeno, que es gaseoso en condiciones ambientales. | Sulfuros y óxidos Ej: ZnS y SiO2 |
Atmósfera, organismos vivos y minerales. |
| 17 | Forman moléculas diatómicas y son muy reactivas. Son malos conductores de electricidad y calor. Son agresivos con los seres vivos y el medio ambiente. | Ácidos y Sales. Ej: HCl y KBr |
Están presentes en sustancias orgánico y mineral. |
| 18 | Son muy estables y se encuentran en forma de gases. | Apenas forman sustancias compuestas. | Gases en la atmósfera. |
Las propiedades químicas y físicas distinguen a una familia de otra. Como hemos visto, las propiedades químicas están relacionadas con electrones de valencia, y a través de ellos, un átomo interactúa con otro, siendo responsable del comportamiento químico y enlaces químicos formado.
Las propiedades físicas de los elementos del mismo grupo pueden variar según el número atómico y la masa.
Ejercicios
Ahora que sabe un poco más sobre las familias de tablas periódicas, pruebe sus conocimientos y vea lo que ha aprendido.
1) Considere el siguiente extracto de la tabla periódica.
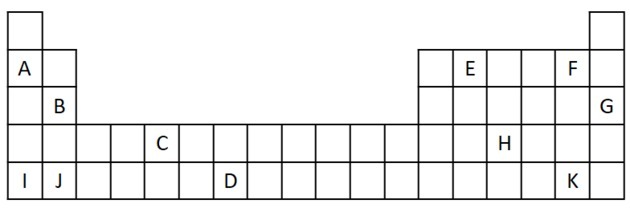
a) Nombra dos elementos que tengan dos electrones de valencia.
b) Indique un elemento que reacciona violentamente con el agua produciendo un hidróxido metálico.
c) Indique un elemento no reactivo.
d) Indique dos elementos que se combinan con metales alcalinos para formar sales.
Respuesta:
a) B y J
Dos electrones de valencia corresponden al grupo 2, que tiene una configuración de electrones ns2 y están representados en el ejercicio por B y J.
b) A, B, I o J.
A y yo representamos elementos de la familia 1; B y J son de la familia 2. Como vimos en la tabla de propiedades, los elementos del grupo 1 y 2 son muy reactivos y pueden formar hidróxidos, como en los ejemplos dados: KOH y Mg (OH)2.
c) G
Los gases nobles son muy estables y, por tanto, poco reactivos. La letra G se inserta en la tabla como un elemento de esta familia.
d) F y K
Los halógenos reaccionan con los metales alcalinos para formar sales. El ejemplo más común de esto es la sal de mesa, NaCl.
2) La siguiente figura muestra tres elementos químicos, de izquierda a derecha, litio, sodio y potasio.

Seleccione la opción que complete correctamente cada una de las siguientes declaraciones.
1.1) "Podemos decir que el litio, el sodio y el potasio ...
(A)... pertenecen al mismo período ".
(B)... tiene el mismo número atómico ".
(C)... pertenecen al mismo grupo ".
(D)... tiene el mismo número de masa ".
1.2) "Los elementos litio, sodio y potasio ...
(A)... tiene propiedades químicas muy similares ".
(B)... tiene propiedades químicas muy diferentes ".
(C)... son no metales ".
(D)... reaccionar con agua para formar soluciones ácidas ".
Respuestas:
1.1) (C) pertenecen al mismo grupo.
1.2) (A) tiene propiedades químicas muy similares.
Podemos obtener esta información consultando la tabla periódica o realizando la distribución electrónica de los elementos litio, sodio y potasio. Veremos que los tres tienen un electrón en la capa de valencia y como forman parte del mismo grupo, las propiedades químicas son muy similares.
3) Considere la siguiente tabla, donde se representan los números atómicos y las distribuciones electrónicas de algunos elementos químicos.
| Elemento | símbolo químico | número atómico | Distribución electrónica |
|---|---|---|---|
| Litio | leer | 3 | 2,1 |
| Berilio | ser | 4 | 2,2 |
| Flúor | F | 9 | 2,7 |
| neón | Eh | 10 | 2,8 |
| cloro | Cl | 17 | 2,8,7 |
| argón | Aire | 18 | 2,8,8 |
| Potasio | K | 19 | 2,8,8,1 |
| Calcio | Aquí | 20 | 2,8,8,2 |
Indique el grupo de cada elemento.
Respuesta:
Litio y potasio: grupo 1. (Tienen un electrón en la capa de valencia).
Berilio y calcio: grupo 2. (Tienen dos electrones en la capa de valencia).
Flúor y cloro: grupo 17. (Tienen siete electrones en la capa de valencia).
Neón y argón: grupo 18. (Tienen ocho electrones en la capa de valencia).
Verifique las preguntas del examen de ingreso con una resolución comentada en Ejercicios de la tabla periódica y preguntas inéditas sobre el tema en Ejercicios para organizar la tabla periódica.
