La ebullición es el cambio de estado líquido a gaseoso. Ocurre cuando una porción de líquido, sometida a una determinada presión, recibe calor y alcanza una determinada temperatura.
La cantidad de calor que debe recibir el cuerpo para transformarse completamente en vapor depende de la sustancia que lo constituye.
Una sustancia en estado líquido no tiene una forma definida, asumiendo la forma del recipiente que la contiene.
Al ser prácticamente incomprensible, presenta una fuerza de cohesión entre las partículas que lo constituyen.
Para pasar al estado gaseoso, la sustancia debe recibir calor. Este aumento de energía hará que las moléculas vibren con mayor intensidad, aumentando la distancia entre ellas.
De esta manera, la fuerza cohesiva se vuelve prácticamente inexistente. El cuerpo en este estado no tiene forma ni volumen definidos.
Los géiseres son ejemplos de ebullición que ocurre con el agua subterránea ubicada en regiones volcánicas. El magma calienta el agua y cuando alcanza cierta temperatura comienza a cambiar de estado.
El vapor ocupa un mayor volumen, aumentando la presión en la cavidad subterránea. Como resultado, una mezcla de vapor y líquido se expulsa a la superficie a través de pequeñas grietas.

Características de ebullición
Un líquido hierve con el siguiente patrón:
- Manteniendo la presión constante, la temperatura durante todo el proceso de ebullición se mantendrá constante.
- La cantidad de calor por unidad de masa requerida para que un líquido se transforme completamente en vapor se llama calor latente de vaporización. Su valor depende de la sustancia que forma el líquido.
- La temperatura a la que hierve cada sustancia está bien determinada y se llama punto de ebullición.
Consejo: Cuando cocinemos alimentos, es una buena idea encender el fuego a fuego lento cuando el agua comience a hervir. Como la temperatura permanece constante durante todo el proceso de ebullición, el tiempo de cocción será el mismo con fuego alto o bajo. De esta forma, ahorramos gas y el medio ambiente está agradecido.
Cantidad de calor latente
La cantidad de calor que debe recibir un líquido para transformarse en vapor depende del valor del calor latente de vaporización y de su masa.
A continuación presentamos el valor del calor latente de vaporización de algunas sustancias:

Fórmula
Para calcular la cantidad de calor necesaria para que un líquido cambie de estado, usamos la siguiente fórmula:
Dónde,
Qv: cantidad de calor (cal)
m: masa (g)
Lv: calor latente de vaporización (cal / g)
Ejemplo:
¿Cuánto calor se necesita para que hiervan 100 g de etanol y se conviertan completamente en vapor?
Qv = 100. 204 = 204 000 cal
Temperatura de ebullición
La temperatura a la que un cuerpo se somete a ebullición depende de la sustancia que lo compone y de la presión a la que está sometido.
El punto de ebullición de las sustancias se determina en el laboratorio. Por ejemplo, el punto de ebullición del agua, sometida a 1 atmósfera, es 100 ° C. El hierro es de 2800 ºC, mientras que el hidrógeno es de - 252,8 ºC.
Para conocer la temperatura de cambio de fase de otras sustancias, lea también punto de ebullición.
Cuanto menor es la presión a la que se somete un cuerpo, menor es su punto de ebullición. Esto significa que en las ciudades con grandes alturas, se tarda mucho más en cocinar los alimentos.
Para cocinar los alimentos más rápido, utilizamos ollas a presión. Este tipo de olla utiliza un sistema de sellado que hace que la presión en su interior sea mayor que la presión atmosférica.
La presión más alta también aumenta el punto de ebullición. En el caso del agua, hervirá a una temperatura que puede llegar a los 120 ºC, reduciendo el tiempo de cocción.
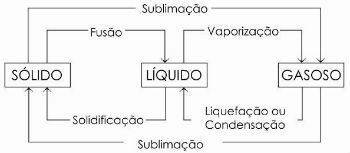
cambios de fase
El cambio de estado líquido a gaseoso se denomina genéricamente vaporización, ya que engloba, además de la ebullición, otros dos procesos: evaporación y calefacción.
La evaporación ocurre gradualmente, sin necesidad de alcanzar una temperatura específica para que ocurra. Por otro lado, el calentamiento se produce cuando colocamos el líquido sobre una superficie que se encuentra a una temperatura superior a su punto de ebullición.
Aún existen otros procesos de cambio de estado. Son ellos:
- Fusión
- Solidificación
- Licuefacción o Condensación
- Sublimación
En el siguiente diagrama representamos los tres estados físicos de la materia y los respectivos cambios de estado:
Para obtener más información, lea también Estados físicos del agua.
Ejercicios
Enem - 1999
El texto debe utilizarse para las dos preguntas siguientes.
La olla a presión permite cocinar los alimentos en agua mucho más rápido que las ollas convencionales. Su tapa tiene una junta de goma que no deja escapar el vapor, salvo por un orificio central sobre el que descansa un peso que controla la presión. Cuando está en uso, se acumula una alta presión en el interior. Para su funcionamiento seguro, es necesario observar la limpieza del orificio central y la existencia de una válvula de seguridad, normalmente ubicada en la tapa.
El esquema de la olla a presión y el diagrama de la fase del agua se presentan a continuación.
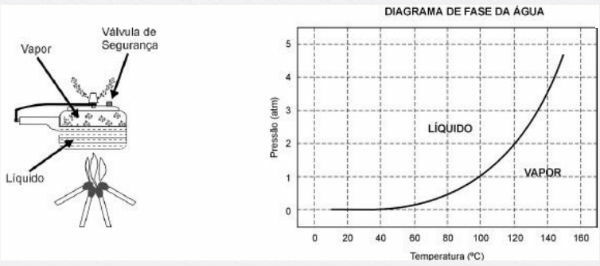
1) La ventaja de utilizar una olla a presión es la velocidad de cocción de los alimentos y esto se debe a
a) la presión en su interior, que es igual a la presión en el exterior.
b) la temperatura de su interior, que está por encima de la temperatura de ebullición del agua del lugar.
c) la cantidad de calor adicional que se transfiere a la sartén.
d) la cantidad de vapor que libera la válvula.
e) el grosor de su pared, que es mayor que el de las cacerolas comunes.
Alternativa b: a su temperatura interior, que está por encima de la temperatura de ebullición del agua del lugar.
2) Si, por economía, bajamos el fuego en una olla a presión en cuanto sale el vapor por la válvula, para simplemente mantener el tiempo de ebullición, el tiempo de cocción.
a) será más grande porque la sartén se “enfría”.
b) será más pequeño, ya que reduce la pérdida de agua.
c) será mayor a medida que disminuya la presión.
d) será mayor a medida que disminuya la evaporación.
e) no cambiará ya que la temperatura no cambia.
Alternativa e: no se cambiará ya que la temperatura no varía.