La alotropía es un fenómeno que ocurre cuando un mismo elemento químico tiene la propiedad de formar más de una sustancia simple.. Estas variedades alotrópicas pueden diferir debido al número de átomos del elemento que están unidos en una molécula o debido a la disposición de los átomos en la red cristalina.
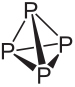
Uno de los elementos que tienen las variedades alotrópicas es el fósforo (P), siendo el más común el fósforo blanco es el fósforo rojo. Estos dos alótropos de fósforo se diferencian no por su disposición espacial diferente, ya que ambos están formados básicamente por moléculas tetraédricas, sino la cantidad de átomos de fósforo es diferente en cada uno.
Vea la constitución y características principales del fósforo blanco y rojo:
- Fósforo blanco:
La fórmula molecular del fósforo blanco es PAG4, lo que significa que sus moléculas están formadas por cuatro átomos de fósforo.

Este tipo de fósforo es extremadamente reactivo, en gran parte debido a la tensión en los ángulos de 60 ° entre sus enlaces. Es tan reactivo que debe almacenarse en agua para que no entre en contacto con el aire y explote. Se debe tener mucho cuidado al manipularlo, ya que provoca graves quemaduras en la piel y envenenamiento si se ingiere (solo 0,1 g de fósforo blanco ingerido puede provocar la muerte).
Como puede ver a continuación, el fósforo blanco es un sólido blanco parecido a una cera.

Fósforo blanco almacenado en agua para que no entre en contacto con el aire *
Si se calienta en ausencia de aire, el fósforo blanco se convierte en fósforo rojo.
- fósforo rojo:
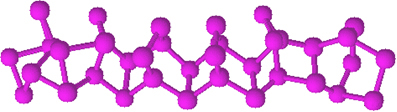
El fósforo rojo no tiene una estructura determinada, pero hay evidencia de que se trata de macromoléculas formadas por la unión de las estructuras tetraédricas mencionadas (P4), siendo representada por PAGNo.
Es mucho menos reactivo que el fósforo blanco, sin embargo, puede encenderse si se frota. Por eso se utiliza en las superficies laterales de las cajas de cerillas. Cuando frotamos el palillo en la superficie de la caja, el fósforo se enciende y, a su vez, enciende el material altamente inflamable en la cabeza del palillo.
En algunos países, el fósforo se coloca en la cabeza del palillo en forma de P4s3.
El fósforo rojo es un polvo amorfo, es decir, no tiene estructura cristalina y es de color rojo oscuro, como se muestra a continuación:

Polvo de fósforo rojo.
* La autoría de la imagen pertenece a W. Oelen y ella se puede encontrar aqui.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/alotropia-fosforo.htm
