A moléculas son estructuras que tienen una masa molar determinada y un número relativamente pequeño y exacto de átomos unidos entre sí de forma covalente, es decir, mediante el intercambio de electrones.
Vea tres ejemplos:
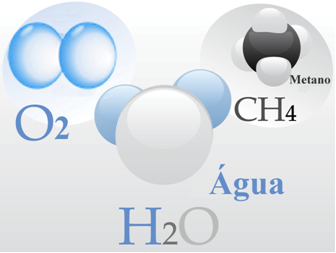
- Oxígeno gaseoso: cada una de sus moléculas está formada por un doble enlace, es decir, por el intercambio de dos pares de electrones entre dos átomos de oxígeno (O2);
- Agua: está formada por moléculas de H2O. Lo que significa que cada molécula tiene dos átomos de hidrógeno que comparten un par de electrones cada uno con un átomo de oxígeno.
- Metano: este compuesto está formado por moléculas de CH.4, en el que cuatro átomos de hidrógeno se unen covalentemente a un átomo de carbono.
Las sustancias moleculares tienen algunas propiedades características, como:
- Solubilidad variada en agua y otros solventes;
- Pueden presentarse en los tres estados físicos;
- En general, son aislantes eléctricos, tanto sólidos como líquidos.
Todas las moléculas están formadas por elementos no metálicos, es decir, solo incluyen hidrógeno, no metales y semimetales. Pero estos elementos también pueden formar sustancias que solo están presentes en estado sólido y que tienen propiedades muy diferentes a las de las moléculas. estos son los
macromoléculas.Macromoléculas, también conocidas como sólidos covalentes o sólidos de la red covalente,son estructuras con una masa molar muy alta e imprecisa, además de estar formadas por una gran e indeterminada cantidad de átomos que se unen covalentemente para formar retículas tridimensionales. Las macromoléculas forman el cristales covalentes o cristales atómicos.
No pares ahora... Hay más después de la publicidad;)
Por ejemplo, los átomos de carbono pueden compartir electrones de muchas formas y formar muchas sustancias simples diferentes. Esta propiedad que tiene un mismo elemento químico para formar dos o más sustancias simples diferentes recibe el nombre de alotropía.
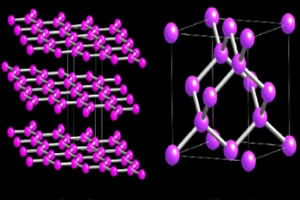
Dos variedades alotrópicas de carbono que forman macromoléculas son las Diamante y el grafito. En las imágenes de abajo se puede ver que, en el caso del diamante, cada átomo de carbono se une a otros cuatro átomos de carbono y da lugar a una macromolécula con estructura tetraédrica.

Mientras tanto, la estructura de grafito está formada por anillos hexagonales contenidos en un mismo plano. Los átomos de carbono forman un enlace doble y dos enlaces sencillos.

Pero las macromoléculas no están compuestas únicamente por un solo tipo de elemento; también pueden formarse a partir de átomos de diferentes elementos químicos.
Un ejemplo es el dióxido de silicio (cuarzo), cuyas macromoléculas tienen cada átomo de silicio rodeado por cuatro átomos de carbono y cada átomo de oxígeno unido a dos átomos de silicio.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Moléculas y macromoléculas"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/moleculas-macromoleculas.htm. Consultado el 28 de junio de 2021.
Química
Qué es la alotropía, sustancias simples, gas oxígeno, ozono, formas alotrópicas, elemento químico oxígeno, rayos ultravioleta del sol, diamante, grafito, atomicidad, fósforo blanco.
Fórmula espacial del carbono, fórmula electrónica de Lewis, estructura plana, pares electrónicos, enlace covalente, capa de valencia, evolución del modelo atómico, fórmula molecular, fórmula estructural, fórmulas tridimensional.
Fórmulas químicas, fórmula estructural plana, fórmula estructural de Couper, triple enlace, gas nitrógeno, fórmula electrónica, fórmula de Lewis, fórmula molecular, enlace simple, enlace doble, gas carbónico.

