El nombre químico de vitamina C é Ácido L-ascórbico, o simplemente ácido ascórbico. Este nombre transmite las funciones químicas y biológicas de este compuesto. El aspecto químico es que es ácido, ya que contiene en su estructura un grupo hidroxi fenólico. El grupo fenólico unido al tercer carbono de la cadena sufre ionización en solución acuosa, como se muestra a continuación, liberando el ion hidroxón (H3O+), que es característico del comportamiento ácido:
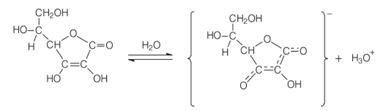
La palabra "ascórbico" proviene de su propiedad biológica para combatir la enfermedad llamada escorbuto. Y la "L" proviene del hecho de que el ácido ascórbico tiene un centro asimétrico en el carbono 5, que tiene actividad óptica. Sin embargo, su actividad antiescorbuto deriva casi en su totalidad del isómero L (levogyro), que tiene una rotación específica en el agua de 24 °.
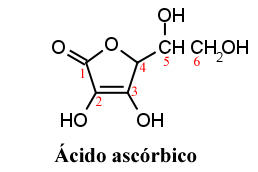
El ácido ascórbico fue aislado por primera vez por el investigador húngaro Szent-Györgi en 1922 como un polvo cristalino blanco.
Los seres humanos y otros animales como los monos, algunas aves y algunos peces no pueden sintetizar la vitamina C. La deficiencia de esta vitamina en el cuerpo conduce a una síntesis defectuosa de tejido colágeno y a la enfermedad antes mencionada, la
escorbuto.Entre los principales fuentes de vitamina C, contamos con frutas frescas, como cereza, anacardo, guayaba, grosella negra, mango, naranja, acerola, tomate, entre otras. Las papas también son una gran fuente de vitamina C, al igual que los pimientos y las verduras de hoja (bertalha, brócoli, col rizada, nabos, hojas de mandioca y ñame).

Decimos "frutas Fresco”Porque la vitamina C puede destruirse total o parcialmente durante largos períodos de almacenamiento. Por ejemplo, cada mes almacenada, la papa pierde el 15% de su vitamina C. Además, el calor también puede destruirlo. Los alimentos cocidos durante mucho tiempo y los alimentos que se han sometido a un procesamiento industrial contienen poca vitamina C. En el caso de la patata, si se cocina sin piel, inmediatamente perderá entre un 30% y un 50% de su propiedad.
Una de las principales propiedades del ácido ascórbico es su capacidad para actuar como agente reductor. Dado que tiene una facilidad excepcional para oxidarse en solución acuosa, es un agente poderoso antioxidante, ya que puede oxidarse en lugar de otros compuestos.
Por ejemplo, en la vida cotidiana cuando cortamos ciertas frutas, como peras, plátanos y manzanas, se oscurecen con el tiempo. Esto se debe a que estos frutos contienen la enzima polifenol oxidasa, que provoca la oxidación enzimática de compuestos fenólicos naturales en presencia de oxígeno molecular, formando quinonas. Polimerizan y generan melaninas, que son exactamente los pigmentos oscuros e insolubles que vemos que se forman en estas frutas.
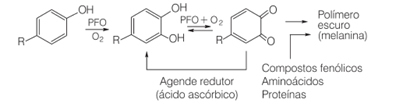
Una de las formas de inhibir la acción de la enzima polifenol oxidasa es la adición de ácido ascórbico. Esto se hace, por ejemplo, cuando agregamos jugo de naranja a la ensalada de frutas.
En presencia de oxígeno y un catalizador, el ácido ascórbico se oxida, convirtiéndose en el ácido deshidroascórbico. Este ácido tiene un pH por debajo de 4, y una disminución del pH del tejido de la fruta hace que la reacción de pardeamiento se ralentice. A pH por debajo de 3, no hay actividad enzimática.
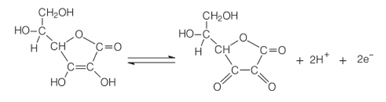
Esta propiedad de la vitamina C se usa ampliamente en industria de alimentos para prevenir la aparición de sabores desagradables, toxicidad y por razones económicas, ya que estima que alrededor del 50% de la pérdida de frutas tropicales en el mundo se debe a la enzima polifenol oxidasa.
Debido a su función antioxidante, la vitamina C también se utiliza en productos cosméticos. Su aplicación tópica a través de estos cosméticos le permite alcanzar niveles que no son posibles con la ingesta oral de vitamina C sola. Protege la piel contra los rayos UV y los radicales libres que provocan un envejecimiento prematuro.

Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/composicao-aplicacoes-vitamina-c.htm

