El químico francés Joseph Louis Proust (1754-1826) procedió a realizar cuidadosos experimentos relacionando las masas de los componentes de ciertas reacciones.
Por ejemplo, los elementos que componen el agua son hidrógeno y oxígeno. Proust descubrió que en esta reacción de formación de agua, el hidrógeno siempre reaccionaba con el oxígeno en una proporción constante y definida, que era de 1: 8, respectivamente. Vea cómo sucede esto a continuación:

Darse cuenta de no importa cuánta masa de elementos se utilice, la proporción siempre será la misma.
Proust señaló que este no era solo el caso del agua, sino de todas las demás sustancias.
Se forman 15,06 g de sulfuro cúprico (CuS), por ejemplo, haciendo reaccionar 10,00 g de cobre metálico (Cu) con 5,06 g de azufre (S). Entonces, si duplicamos la cantidad de cobre (que irá a 20.0 g), y si queremos que todo el cobre reaccione, También será necesario duplicar la cantidad de azufre, a 10,12 g, con la formación total de 30,12 g de sulfuro.
Ahora bien, si se agrega una cantidad que no es proporcional, la cantidad sobrante quedará, no reaccionará. Tenga en cuenta esto a continuación:
No pares ahora... Hay más después de la publicidad;)
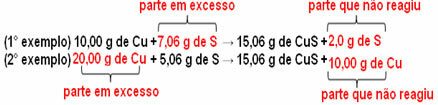
Darse cuenta de la reacción solo tiene lugar de acuerdo con la proporción definida. Por lo tanto, en 1799, Proust concluyó que, cuando varias sustancias se combinan para formar un compuesto, esto siempre se hace en una relación de masa definida.
Entonces creó una ley que se llama Ley de Proust, Ley de proporciones constantes o Ley de proporciones definidas, que se expresa de la siguiente manera:

Esta ley y la Ley de Lavoisier (Ley de conservación masiva) son llamados Leyes de peso, porque hablan en masas de sustancias involucradas.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Ley de Proust o ley de proporciones constantes"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Consultado el 27 de junio de 2021.

