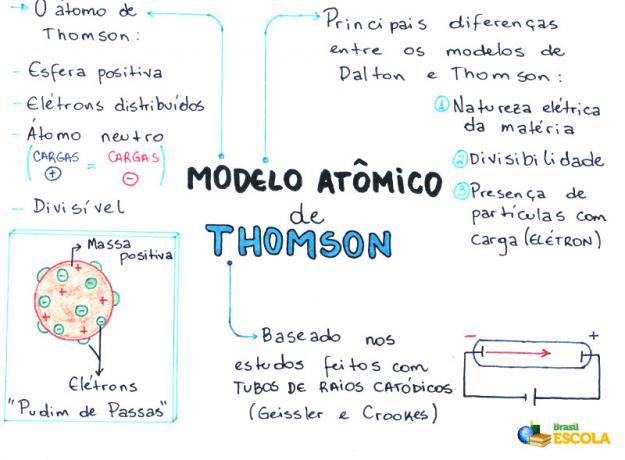
O Modelo atómico de Thomson fue propuesto en el año 1898 por el físico inglés Joseph John Thomson o, simplemente, J.J. Thomson. Después de tener varios evidencia experimental de la existencia del electrón, anuló la teoría de la indivisibilidad del átomo propuesta por John Dalton.
Thomson, basándose en su modelo, confirmó y demostró la existencia de electrones (partículas con carga eléctrica negativa) en el átomo, es decir, el átomo tiene partículas subatómicas.
Mapa mental: modelo atómico de Thomson
* Para descargar el mapa mental en PDF, Haga clic aquí!
Thomson propuso su modelo atómico basado en descubrimientos relacionados con la radiactividad y experimentos llevados a cabo con el tubo de rayos catódicos construido por los científicos Geissler y Crookes. Vea una representación de este tubo:
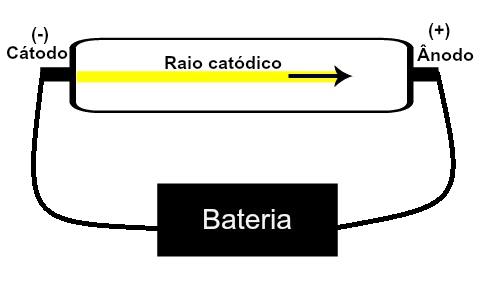
Cuando un gas enrarecido a baja presión se somete a un alto voltaje eléctrico (por ejemplo, 15000 V), produce un haz de luz (compuesto por cargas eléctricas) desde el cátodo (polo negativo) hacia el ánodo (polo positivo).
Con este experimento, Thomson llegó a la conclusión de que cuando los átomos del material gaseoso del interior del tubo fueron sometidos a un alto voltaje, sus electrones fueron arrancados y dirigidos a la placa positivo.
Consideraciones propuestas por el modelo atómico de Thomson
Con los experimentos realizados con el tubo de rayos catódicos, Thomson propuso su interpretación de cómo sería el átomo y su constitución. Entonces, según él:
- El átomo es una esfera, pero no masiva como propone el Modelo atómico de John Dalton;
- El átomo es neutro, ya que toda la materia es neutra;
- Como el átomo tiene electrones, que tienen cargas negativas, debe tener partículas positivas para que la carga final sea nula;
- Los electrones no están fijos ni atrapados en el átomo, pueden transferirse a otro átomo bajo ciertas condiciones;
- El átomo se puede considerar como un fluido continuo con cargas positivas donde se distribuirían los electrones, que tienen carga negativa;
- asoció tu modelar a un pudín de pasas (que representan los electrones);
- Como los electrones que se encuentran dispersos tienen la misma carga, existe una repulsión mutua entre ellos, lo que los distribuye uniformemente en la esfera.
Novedades propuestas al átomo por el modelo de Thomson
El modelo atómico de Thomson fue el segundo propuesto para el átomo. El primer modelo fue formulado por John Dalton.
No pares ahora... Hay más después de la publicidad;)
El modelo de Thomson abordó nuevos conocimientos sobre el átomo que hasta entonces no se habían propuesto por falta de base científica, tales como:
- Naturaleza eléctrica de la materia;
- Escindibilidad del átomo;
- Presencia de pequeñas partículas cargadas en el átomo.
Problemas señalados al átomo de Thomson
Varios físicos en el momento de la propuesta de la Modelo atómico de Thomson, basado en las teorías de la física clásica, señaló algunas inconsistencias presentes en este modelo:
- Thomson propuso que el átomo tenía una estabilidad en relación con la distribución uniforme de electrones, que podría modificarse por la influencia de la energía. Sin embargo, la Física Clásica, basada en electromagnetismo, no permite la existencia de un sistema estable basado únicamente en la repulsión entre partículas de la misma carga;
- Para Thomson, los electrones se distribuyen uniformemente en el átomo, pero tienen la capacidad de cambiar de forma acelerada y, por tanto, debe emitir radiación electromagnética a determinadas frecuencias específico. Sin embargo, esto no se observó.
- El modelo de Thomson fue a menudo ineficaz para explicar propiedades atómicas como su composición y organización.
* Mapa mental de Victor Ricardo Ferreira
Profesor de química
Por mí. Diogo Lopes Dias
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
DÍAS, Diogo Lopes. "Modelo atómico de Thomson"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Consultado el 27 de junio de 2021.
Química

Niels Bohr, átomo de Bohr, física atómica, átomo estable, modelo atómico, sistema planetario, capas de la electrosfera, niveles de energía, capas de electrones, energía de electrones, modelo atómico de Rutherford, átomo en estado excitado.
Química

Los átomos y la construcción del Universo, teoría atómica, que todo está hecho, la materia está formada por átomos, teoría de los cuatro elementos, alquimistas antiguos, teoría atómica, partícula fundamental.