isómero óptico es un tipo de isomería espacial cuyo objetivo principal es estudiar el comportamiento de moléculas que presentan asimetría, es decir, que no se superponen entre sí.

imagen de espejo de mano izquierda
Las moléculas que no son superponibles (moléculas asimétricas) se pueden comparar con la mano derecha y su imagen especular. En la imagen de arriba, tenemos que la imagen especular de la mano izquierda es la mano derecha, que no se superponen.
Las principales diferencias entre las moléculas que presentan isomería óptica están en la influencia que causan o no en luz polarizada, pudiendo desviar o no la luz, y en relación a sus propiedades físicas y químicas.
Afirmar que una sustancia tiene isomería óptica, debemos buscar en sus moléculas la presencia de al menos una carbono asimétrico (también llamado carbono quiral), que es un carbono que tiene cuatro ligandos diferentes, como en el siguiente ejemplo:

Carbono con cuatro ligantes diferentes
El carbono de arriba tiene los ligandos de hidrógeno (H), metilo (CH)3), bromo (Br) y etilo (H3C-CH2) y por lo tanto es un carbono quiral.
Vea ahora los tipos de isómeros estudiados en Isomería óptica:
Isómeros ópticos activos
También llamado antípodas ópticas, enantiomorfos o moléculas quirales, son moléculas orgánicas que tienen la capacidad de cambiar la dirección de la luz polarizada hacia la izquierda o hacia la derecha.
La molécula de un compuesto orgánico que puede desviar la luz hacia la derecha se llama diestro. La molécula del mismo compuesto orgánico que es capaz de desplazar la luz hacia la izquierda se llama levorotario.
No pares ahora... Hay más después de la publicidad;)
Cada compuesto orgánico que tiene un carbono quiral tiene automáticamente una molécula de la mano derecha y una molécula de la mano izquierda. Sin embargo, si un determinado compuesto orgánico tiene más de un carbono quiral, tenemos que usar el fórmula propuesta por el científico Van't Hoff para determinar el número de moléculas diestras y levoreiras. Vea:
IOA = 2C
IOA = isómeros ópticamente activos;
C = número de carbonos quirales en la molécula.
Isómeros ópticos inactivos
También llamado mezcla racémica, en los isómeros ópticos inactivos, tenemos la misma cantidad de moléculas de la derecha y de la izquierda en un recipiente. Esta mezcla no tiene la capacidad de cambiar la dirección de la luz polarizada ni a la izquierda ni a la derecha.
De acuerdo con la regla propuesta por el científico Van't Hoff, para determinar el número de mezclas racémicas formadas por un compuesto orgánico, basta con utilizar la siguiente expresión:
IOI = 2C
2
IOI = isómeros ópticamente inactivos;
C = número de carbonos quirales en la molécula.
isómero meso
isómero meso es la molécula que tiene dos carbonos quirales iguales, es decir, ambos carbonos tienen los mismos cuatro ligandos, como en el siguiente ejemplo:

El ácido tartárico tiene un isómero meso
Los ligandos para los carbonos 2 y 3 son exactamente los mismos: un hidroxilo (OH), un carboxilo (COOH), un hidrógeno (H) y el grupo carbohidroxicarboxilo (CHOHCOOH).
Dado que el isómero meso tiene dos carbonos quirales iguales, el efecto que uno de estos carbonos tiene sobre la luz polarizada se anula por el efecto del otro carbono. Por tanto, es un isómero ópticamente inactivo.
Por mí. Diogo Lopes Dias
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
DÍAS, Diogo Lopes. "¿Qué es la isomería óptica?"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria-optica.htm. Consultado el 28 de junio de 2021.
Química
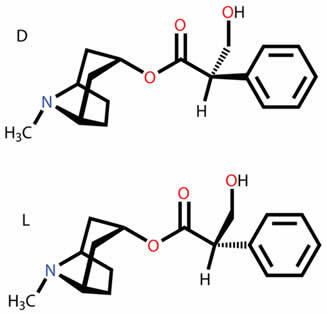
Sepa de qué se tratan los diversos tipos de isómeros planos y espaciales, como función, posición, cadena, tautomería, metamerismo, isomería cis-trans geométrica y óptica.