Desde la antigüedad, el hombre se ha interesado en responder a la pregunta sobre la constitución de la materia.
Varias personalidades de la comunidad científica se pronunciaron sobre el tema, pero no fue hasta finales del siglo XIX cuando se empezaron a desentrañar los misterios sobre la composición atómica.
El antiguo filósofo Leucipo, por ejemplo, creía que el átomo estaba formado por partículas diminutas.
Después de esta definición, Demócrito y Dalton propusieron que las partículas atómicas eran masivas e indivisibles.
Este hecho fue luego cuestionado por Thomson, un físico inglés que descubrió la existencia del electrón y pudo, entonces, confirmar la idea previamente propuesta por Leucipo.
Tras este descubrimiento, Thomson presentó un modelo en el que el átomo estaba formado por una esfera de cargas positivas y dentro del núcleo había electrones.
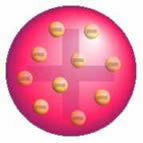
Modelo del átomo de Thomson: en una esfera de masa uniformemente distribuida y cargada positivamente,
estarían incrustados con electrones cargados negativamente, como en un pudín.
Incluso después de la teoría de Thomson, el modelo atómico todavía tenía una deficiencia teórico-experimental, capaz de probar su veracidad.
El tema fue nuevamente discutido calurosamente cuando el equipo del físico Rutherford notó que había una desviación muy grande (y inexplicable, según la teoría del pudín de pasas) cuando algunas partículas alfa radiactivas atraviesan una fina capa de lámina metálico.
Después de analizar y estudiar el hecho, Rutherford llegó a la conclusión de que el radio del átomo es 10.000 veces mayor que el radio del núcleo.
A través de todo el estudio del átomo, Rutherford y su equipo llegaron, en 1911, a un modelo atómico, al que llamaron modelo planetario del átomo.
No pares ahora... Hay más después de la publicidad;)

En 1913, Niels Bohr descifró el modelo atómico, aplicando el cuanto de acción descubierto por Planck a sus estudios. El cuanto de acción era, de hecho, el gran comodín que vendría a completar y aclarar el modelo atómico.
Bohr ajustó de manera eficiente y sencilla el modelo presentado por Rutherford y llegó a la siguiente conclusión:
El electrón adquiere energía, que se representa a través de una órbita definida. Las órbitas permitidas forman los niveles de energía.

Por Talita A. angeles
Licenciada en Física
Equipo Escolar de Brasil
Física Moderno - Física - Escuela Brasil
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
ÁNGELES, Talita Alves dos. "Del átomo de Rutherford al átomo de Bohr"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm. Consultado el 27 de junio de 2021.