A fuerzas intermoleculares, genéricamente llamado Las fuerzas de van der Waals, hay tres: dipolo inducido inducido por dipolo, enlaces de hidrógeno y dipolo permanente-dipolo permanente. En este texto, consideraremos solo la última de estas tres fuerzas:
La fuerza dipolo permanente-dipolo permanente, o simplemente, dipolo-dipolo ocurre solo en moléculas polares, es decir, aquellos que no tienen una distribución de carga uniforme a lo largo de su superficie. Por citar un ejemplo, en la molécula de HCl (gas clorhídrico) la nube electrónica está más desplazada hacia el átomo de cloro, ya que es más electronegativa que el hidrógeno.
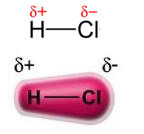
Tenga en cuenta que alrededor del átomo de cloro hay una acumulación de electrones, lo que provoca la formación de un polo negativo, que está simbolizado por la letra griega delta (-δ). Como resultado, en la región alrededor del átomo de hidrógeno un polo positivo (+δ), ya que tiene baja densidad electrónica. La molécula de HCl constituye entonces una dipolo eléctrico
y, por tanto, al entrar en contacto con otras moléculas de HCl vecinas, existe una fuerza de atracción entre los polos opuestos de las moléculas, como se puede ver a continuación: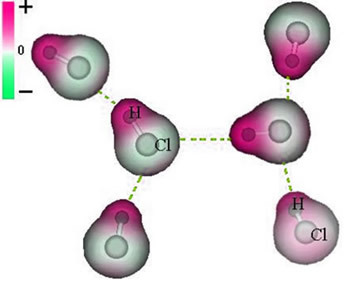
Esta fuerza de atracción, que se establece entre el extremo negativo del dipolo de una molécula con el extremo positivo del dipolo de otra molécula, constituye la fuerza dipolo-dipolo..
Entonces, como su nombre lo dice, el dipolo es permanente, por lo que solo ocurre en compuestos polares. Y cuanto mayor es la polaridad de una molécula, más intensas son las interacciones dipolo-dipolo en la sustancia.
Si está en fase sólida, la formación del dipolo permanente guía la posición de cada molécula en el espacio, formando cristales dipolares; como en el caso del bromuro de hidrógeno que se ilustra a continuación:
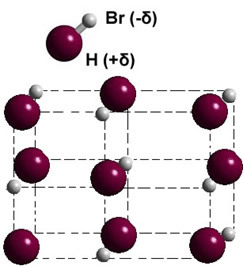
Otros ejemplos de sustancias polares que tienen la fuerza dipolo-dipolo entre sus moléculas son: H2S, CO, HCCl3, SOLO2.
Esta fuerza intermolecular es de intensidad media, ya que es más fuerte que la fuerza de atracción del dipolo inducida por el dipolo, pero menos intensa que el enlace de hidrógeno. Es por eso que sus puntos de fusión y ebullición son más altos que los de las sustancias que tienen una fuerza dipolar inducida. Como la fuerza del dipolo permanente es más fuerte, es necesario suministrar más energía para que se rompan las interacciones de sus moléculas.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm

