O calcular el número de partículas atómicas se utiliza para indicar la cantidad de protones (en el núcleo), electrones (en la electrosfera) y neutrones (en el núcleo) presentes en cualquier átomo o ion. Para ello, es fundamental conocer algunas características de los átomos:
1- Número atómico (Z)
Es un código matemático, representado por la letra mayúscula Z, ubicada en el lado inferior izquierdo de la abreviatura de un átomo:
ZX
Indica el número de protones (p) en el núcleo y el número de electrones (e) en la electrosfera de un átomo. Entonces, en términos generales:
Z = p = e
2- Número de masa (A)
Es un código matemático que corresponde a la suma del número de protones (p) y neutrones (n), ambos presentes en el núcleo de cualquier átomo. La ecuación que representa el número de masa viene dada por:
A = p + n
Dado que el número de protones es igual al número atómico, podemos escribir la ecuación para calcular el número másico de la siguiente manera:
A = Z + n
Si conocemos el número de masa y el número atómico de un átomo, podemos determinar el número de neutrones de la siguiente manera:
n = A - Z
3- iones
Son átomos que pierden o ganan electrones. Tienen un signo positivo o negativo colocado en la parte superior derecha de su representación, como en el siguiente modelo:
X+ o X-
Ión positivo: esto se llama catión y el signo positivo indica que ha perdido electrones.
Ión negativo: se llama anión y el signo negativo indica que ha ganado electrones.
No pares ahora... Hay más después de la publicidad;)
4- Similitudes atómicas
a) Isótopos
Átomos que tienen el mismo número atómico y diferentes números de masa. Ejemplo:
7X14 y 7Y16
Los átomos X e Y tienen el mismo número atómico (a la izquierda del acrónimo), es decir, igual a 7. El átomo X tiene un número de masa (a la derecha del acrónimo) igual a 14, y el átomo Y tiene un número de masa igual a 16.
b) Isobaras
Átomos que tienen el mismo número de masa y diferentes números atómicos. Ejemplo:
15X31 y 13Y31
Los átomos X e Y tienen un número de masa (a la derecha del acrónimo) igual a 31. El átomo X, por otro lado, tiene un número atómico igual a 15 y el átomo Y tiene un número atómico igual a 13.
c) Isotonas
Átomos que tienen diferentes números de masa y números atómicos, pero el mismo número de neutrones.
d) Isoelectrónica
Átomos que tienen el mismo número de electrones. Ejemplo:
12X+2 y 7Y-3
El átomo X tiene un número atómico igual a 12 y es un catión (con carga positiva +2), por lo que pierde dos electrones, por lo que tiene 10 electrones en su electrosfera. El átomo Y, por otro lado, tiene un número atómico igual a 7 y es un anión (con carga negativa -3), por lo que gana tres electrones, por lo que tiene 10 electrones en su electrosfera.
Mapa mental: partículas atómicas
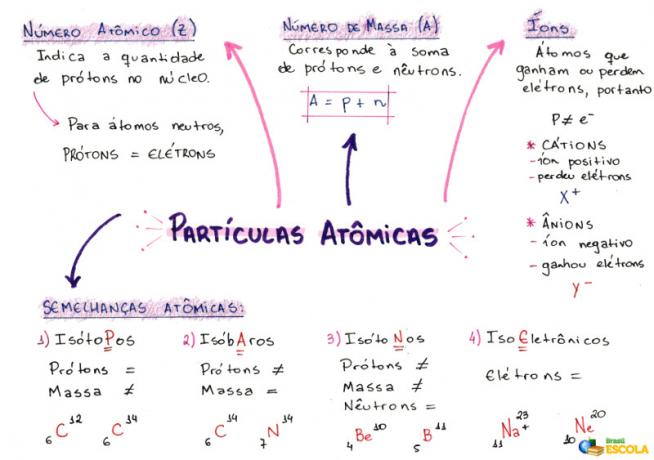
* Para descargar el mapa mental en PDF, Haga clic aquí!
Ejemplos de cálculo del número de partículas atómicas.
Ejemplo 1: Determinar la cantidad de protones, neutrones y electrones en el átomo. 14X29.
Se dieron los siguientes valores para el átomo X:
Número de masa (arriba a la derecha) = 29
Número atómico (abajo a la izquierda) = 14
Para determinar la cantidad de protones:
El número de protones siempre es igual al número atómico, por lo que el átomo X tiene 14 protones.
Para determinar la cantidad de electrones:
Como el átomo X no es un ion, el número de electrones es igual al número de protones, es decir, 14.
Para determinar el número de neutrones:
El número de neutrones se determina utilizando el número de masa y protones en la siguiente fórmula:
A = p + n
29 = 14 + n
29 - 14 = n
n = 15
Ejemplo 2: Determine la cantidad de protones, neutrones y electrones del ion X+3, sabiendo que su número másico y número atómico son, respectivamente, 51 y 23.
Se dieron los siguientes valores para el ion X:
Número de masa = 51
Número atómico (abajo a la izquierda) = 23
Para determinar la cantidad de protones:
El número de protones siempre es igual al número atómico, por lo que el átomo X tiene 23 protones.
Para determinar la cantidad de electrones:
El ion X es positivo (+3), por lo que es un catión que ha perdido tres electrones. Entonces su número de electrones es 20.
NOTA: La reducción o aumento del número de electrones siempre se produce en relación con el número atómico.
Para determinar el número de neutrones:
El número de neutrones se determina utilizando el número de masa y protones en la siguiente fórmula:
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
Ejemplo 3: Un átomo W tiene un número atómico y una masa iguales a, respectivamente, 29 y 57, siendo una isobara de un átomo Y, que tiene un número atómico igual a 30, que es isótopo de un átomo B, cuyo número másico es 65. Con esta información, determine la cantidad de protones, neutrones y electrones en el átomo B.
Datos proporcionados por el ejercicio:
Átomo W
número atómico (abajo a la izquierda) = 29
número de masa (arriba a la derecha) = 57
Y isobar, es decir, la masa de Y también es 57.
Átomo Y
número atómico = 30
número de masa = 57
Con estos dos valores, debemos determinar su número de neutrones porque es isótono del elemento B:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
Una tumba:
número de masa = 65
número de neutrones = 27
Con estos datos debemos determinar su número atómico, porque con eso estaremos determinando su número de protones y su número de electrones (ya que no es un ion):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Por tanto, el átomo B tiene 38 protones, 38 electrones y 27 neutrones.
* Mapa mental de Victor Ricardo Ferreira
Profesor de química
Por mí. Diogo Lopes Dias