Tú aldehídos y las cetonas son funciones orgánicas muy similares. Ambos tienen en su estructura el grupo funcional carbonilo (C = O), con la única diferencia de que, en el caso de aldehídos, siempre aparece al final de la cadena de carbono, es decir, uno de los ligandos de carbono carbonilo es el hidrógeno; las cetonas tienen el carbonilo entre otros dos átomos de carbono.
Grupo funcional aldehídos:Grupo funcional de cetonas:
O O
║ ║
C C ─ H C C ─ C
Por este motivo, existen casos de isomería funcional entre aldehídos y cetonas. Por ejemplo, a continuación presentamos dos isómeros funcionales que tienen la misma fórmula molecular (C3H6O), pero uno es un aldehído (propanal) y el otro es una cetona (propanona). Vea cómo esto cambia totalmente sus propiedades y aplicaciones:
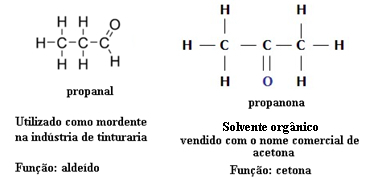
Ejemplo de isomería funcional entre aldehído y cetona
Imagina que estás en un laboratorio y encuentras un frasco con un líquido incoloro que solo tiene la fórmula molecular C3H6O. ¿Qué harías para saber si es una cetona o un aldehído?
Para resolver problemas como este, existen métodos para diferenciar aldehídos y cetonas basados en la reacción de estos compuestos contra agentes oxidantes débiles. Como se muestra abajo, cuando se enfrentan a oxidantes débiles, los aldehídos reaccionan oxidándose, mientras que las cetonas no reaccionan. Nosotros decimos esoLos aldehídos actúan como agentes reductores, pero las cetonas no, solo reaccionan como agentes reductores en contacto con oxidantes energéticos.
Aldehídos + oxidantes débiles → ácido carboxílico
O O
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
Cetonas + oxidantes débiles → No reaccionar
O
║
C ─ C ─ C + [O] → No se produce ninguna reacción
En base a eso, es suficiente entonces realizar esta reacción y ver si el compuesto reacciona o no. Si reacciona, sabemos que es un aldehído; si no reacciona, es una cetona.
Además, los productos formados en estas reacciones de oxidación de aldehídos son bastante visibles, con cambios de color que se producen, como se verá más adelante.
Hay tres métodos principales para diferenciar aldehídos y cetonas, que son:
1- Tollens reactivo: Este reactivo es un solución de amoniaco de nitrato de plata, es decir, contiene nitrato de plata (AgNO3) y exceso de hidróxido de amonio (NH4OH):
AgNO3 + 3 NH4OH → Ag (NH3)OH + NH4EN EL3 + 2 H2O
Tollens Reactive (llamado así por el químico alemán Bernhard Tollens (1841-1918))
Como se explica en el texto Hacer un espejo de plata, cuando un aldehído se pone en contacto con el reactivo de Tollens, se oxida al ácido carboxílico correspondiente, mientras que los iones de plata se reducen a Ag0 (plata metálica). Si esta reacción se lleva a cabo, por ejemplo, en un tubo de ensayo, esta plata metálica se depositará en las paredes del tubo, dando como resultado la formación de una película llamada espejo de plata. Este resultado observado es muy hermoso y se utiliza en el proceso de fabricación de espejos industriales.
No pares ahora... Hay más después de la publicidad;)
La reacción que tiene lugar se puede representar de la siguiente manera:
O O
║ ║
R ─ C ─ H + H2O → R ─ C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 Ag0
2 NH3 + 2 H+ → 2 NH4+
O O
║║
R C ─ H + 2 Ag+ + 2 NH3 + H2O → R C ─ OH + 2 Ag0 + 2 NH4+
aldehído Tollens reactivoácido carboxílico plata metalizada (espejo plateado)
Por otro lado, si ponemos la cetona a reaccionar con el reactivo de Tollens, no se producirá la formación de plata metálica, porque las cetonas no pueden reducir los iones Ag.+.
2- Fehling reactivo: Este reactivo es una solución azul de sulfato de cobre II (CuSO4) en medio básico, ya que se mezcla con otra solución formada por hidróxido de sodio (NaOH) y tartrato de sodio y potasio (NaOOC-CHOH-CHOH-COOK). Se agrega tartrato a la solución de sulfato de cobre II para estabilizarla y evitar su precipitación.
CUSO4 + 2 NaOH → Na2SOLO4 + Cu (OH)2
Fehling Reactive (llamado así por el químico alemán Hermann von Fehling (1812-1885))
En contacto con el reactivo de Fehling, un aldehído forma el ácido carboxílico por oxidación, mientras que los iones de cobre (Cu)2+) presentes en el medio se reducen, formando un precipitado marrón rojizo (más parecido a un ladrillo), que es óxido cuproso. Las cetonas, por otro lado, no reaccionan, porque no pueden reducir los iones Cu2+.
O O
║ ║
R ─ C ─ H + 2 Cu (OH)2 → R ─ C ─ OH + Culo2O + 2 H2O
aldehído precipitado marrón rojizo
3- Reactivo de Benedicto: Este reactivo también está formado por una solución de sulfato de cobre II (Cu (OH)2) en un medio básico, pero se mezcla con citrato de sodio.
Al igual que con el reactivo de Fehling, en el caso de la reacción entre el aldehído y el reactivo de Benedict, también existen iones de cobre (Cu2+) presentes en el medio que se reducen y forman óxido cuproso rojo.
Este reactivo se usa ampliamente en pruebas para detectar la presencia y el contenido de glucosa en la orina. La glucosa tiene un grupo aldehído en su estructura, por lo que reacciona con el reactivo de Benedict presente en tiras para estas pruebas. A partir de ahí, simplemente compare el color de la cinta con el color de la escala en el empaque del producto.

El reactivo de Benedict se utiliza para determinar el contenido de glucosa en la orina.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Diferenciación de aldehídos y cetonas"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm. Consultado el 27 de junio de 2021.
Química

Aldehídos, compuestos carbonílicos, grupo carbonilo, Principales aldehídos, Etanal, materia prima en la industria de pesticidas y medicamentos, Metanal, formaldehído, industria plástica y de resinas.
Química

Cetonas, sustancias orgánicas, grupo funcional carbonilo, obtención de disolvente de esmalte, propanona, cuerpos cetónicos en el torrente sanguíneo, extracción de aceites y grasas de semillas de plantas, disolventes Orgánico.