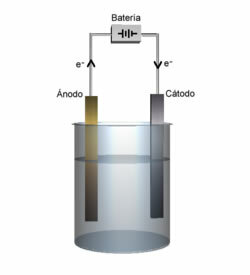
Η ηλεκτρόλυση του νερού συνίσταται στην αποσύνθεση αυτής της ουσίας μέσω ενός ηλεκτρικού ρεύματος και της προσθήκης ενός ηλεκτρολύτη. Ας καταλάβουμε καλύτερα πώς συμβαίνει αυτό;
Διαβάστε επίσης: Τι είναι η ηλεκτρόλυση;
Πώς συμβαίνει η ηλεκτρόλυση του νερού;
Τα μόρια του νερού είναι ικανά αυτο-ιονισμού, δημιουργώντας ιόντα Η+ (ή Η3Ο+και ω-:
Η2O ↔ Η+ + Ω-
ή
2 ώρες2O ↔ Η3Ο+ + Ω-
Ωστόσο, το νερό είναι ένας πολύ αδύναμος ηλεκτρολύτης και παρά το ότι έχουν αυτά τα ιόντα, δεν μπορεί να συμπεριφερθεί ηλεκτρικό ρεύμα. Έτσι, για να πραγματοποιηθεί η ηλεκτρόλυση, δηλαδή η αποσύνθεσή του μέσω ηλεκτρικού ρεύματος, είναι απαραίτητο να προστεθεί ένας ηλεκτρολύτης, μια ιοντική διαλυμένη ουσία που μπορεί να είναι ένα άλας, μια βάση ή ένα οξύ.

Παραγγελία προτεραιότητας για επιλεκτική απαλλαγή
Ωστόσο, όπως εξηγείται στο κείμενο Υδατική ηλεκτρόλυση, σε αυτήν την περίπτωση, δεν θα έχουμε μόνο τα ιόντα που προέρχονται από το νερό, αλλά και εκείνα της ουσίας που διαλύθηκε σε αυτό. Στην ηλεκτρόλυση, μόνο ένα κατιόν και ένα ανιόν εκφορτώνονται στο ηλεκτρόδιο, δηλαδή είναι
επιλεκτική απαλλαγή μετά από σειρά προτεραιότητας.Έτσι, προκειμένου η κάθοδος και η άνοδος που θα εκφορτιστούν να είναι αυτές του νερού και όχι εκείνες της διαλυμένης ουσίας, είναι απαραίτητο να επιλέξετε οξύ, μια βάση ή ένα άλας του οποίου τα ιόντα απορρίπτονται λιγότερο εύκολα από τα ηλεκτρόδια από τα ιόντα στο νερό. Για να γίνει αυτό, πρέπει να συμβουλευτούμε την ουρά προτεραιότητας που φαίνεται παρακάτω:
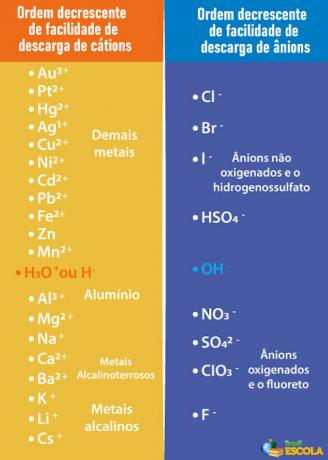
Σημειώστε ότι τα κατιόντα που αναφέρονται κάτω από το H+ έχουν λιγότερη ευκολία εκφόρτωσης από αυτήν. Στον πίνακα στα δεξιά, βλέπουμε ότι τα ανιόντα κάτω από το OH- έχουν λιγότερη ευκολία εκφόρτωσης. Επομένως, μπορούμε να επιλέξουμε, για παράδειγμα, ένα αλάτι, μια βάση ή ένα οξύ που σχηματίζει τα ιόντα Na.+,Κ+, ΣΤΟ3-, ΜΟΝΟ42- και ούτω καθεξής, εκτός από το σχηματισμό των ίδιων ιόντων με το νερό, δηλαδή, H+ και ω-. Μερικά παραδείγματα είναι: θειικό οξύ (Η2ΜΟΝΟ4), υδροξείδιο του νατρίου (NaOH) και νιτρικό κάλιο (KNO3).
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Παράδειγμα με τις αντιδράσεις που σημειώθηκαν στην ηλεκτρόλυση του νερού
Ας πούμε ότι πραγματοποιείται ηλεκτρόλυση νερού με την προσθήκη θειικού οξέος. Σε αυτήν την περίπτωση, θα έχουμε τον σχηματισμό των ακόλουθων ιόντων στη μέση:
Διάσταση οξέος: 1 Η2ΜΟΝΟ4 → 2 Ω+ + 1 SO42-
Αυτοματοποίηση νερού: Η2O → Η+ + Ω- ή 2 ώρες2O → Η3Ο+ + Ω-
Σημειώστε ότι το μόνο υπάρχον κατιόν είναι H.+, έτσι είναι αυτός που θα υποστεί μείωση (κέρδος από ηλεκτρόνια) στο αρνητικό ηλεκτρόδιο (κάθοδος) και θα παράγει αέριο υδρογόνοΟ (Η2).
Τώρα, μιλώντας για ανιόντα, υπάρχουν δύο ανιόντα στη μέση, τα οποία είναι το λειτουργικό σύστημα42- και το ω-. Όπως δείχνει ο παραπάνω πίνακας, το λειτουργικό σύστημα42- είναι πιο αντιδραστικό και λιγότερο εύκολο να εκφορτιστεί. Έτσι, το OH- θα εκφορτιστεί, οξειδώνοντας (χάνοντας ηλεκτρόνια) στο θετικό ηλεκτρόδιο (άνοδο) και θα παράγει αέριο οξυγόνο(Ο2):
Μισή αντίδραση καθόδου: 4 Η3Ο+ +4 και- → Η2Ο + Η2
Ημι-αντίδραση ανόδου: 4 ΟΗ- → 2 Ω2Ο + 1 Ο2 +4 και-
Προσθέτοντας όλη αυτή τη διαδικασία, φτάνουμε στην παγκόσμια εξίσωση:
Ιονισμός νερού: 8 Η2O → 4 Η3Ο+ + 4 Ω-
Μισή αντίδραση καθόδου: 4 Η3Ο+ +4 και- → 4 Η2Ο + 2 Η2
Ημι-αντίδραση ανόδου: 4 ΟΗ- → 2 Ω2Ο + 1 Ο2 +4 και-
Παγκόσμια εξίσωση: 2Η2O → 2 Η2 + 1 Ο2
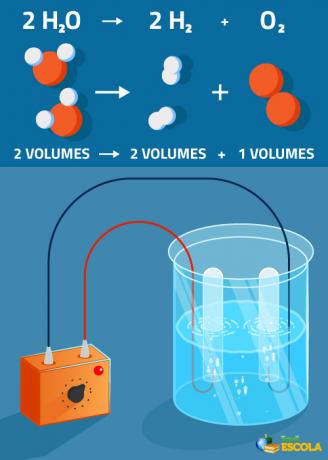
Σημειώστε ότι ο όγκος του παραγόμενου υδρογόνου είναι διπλάσιος του οξυγόνου. Ωστόσο, στην πράξη, αυτός ο αυστηρός λόγος δεν επαληθεύεται επειδή το οξυγόνο είναι πιο διαλυτό από το αέριο υδρογόνο.
Διαβάστε επίσης: Λήψη αργιλίου μέσω ηλεκτρόλυσης
Εφαρμογές ηλεκτρόλυσης νερού
Η ηλεκτρόλυση του νερού είναι μια πολύ σημαντική διαδικασία, δεδομένου ότι το υδρογόνο είναι ένα αέριο που μπορεί να χρησιμοποιηθεί ως καύσιμο. Σαν το καύσιμα που προέρχονται από πετρέλαιο δεν είναι ανανεώσιμα, το αέριο υδρογόνο θα μπορούσε να γίνει μια σημαντική εναλλακτική λύση.
Επιπλέον, υπάρχουν ήδη μέθοδοι παραγωγής βενζίνης που χρησιμοποιούν τη διαδικασία ηλεκτρόλυσης νερού. Δείτε πώς γίνεται αυτό στο κείμενο Οι επιστήμονες είναι σε θέση να μετατρέψουν το διοξείδιο του άνθρακα σε βενζίνη.
Από την Jennifer Fogaça
Καθηγητής Χημείας
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Ηλεκτρόλυση νερού" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/eletrolise-agua.htm. Πρόσβαση στις 28 Ιουνίου 2021.
Χημεία

Εφαρμογές Ηλεκτρόλυσης, ηλεκτρολυτικής επικάλυψης, επιμετάλλωσης νικελίου, επιχρωμίωσης, νικελίου, χρωμίου, καθόδου, νατρίου, αργιλίου, χλωρίου, καυστική σόδα, αέριο υδρογόνο, πυριτική ηλεκτρόλυση, υδατική ηλεκτρόλυση, αλκαλικά μέταλλα, αλκαλική γη, αέριο χλώριο.
Χημεία

Ηλεκτρόλυση, διαλύματα ηλεκτρολυτών, ηλεκτρικό ρεύμα, αντιδράσεις μείωσης οξείδωσης, αυθόρμητη χημική διαδικασία, χημική διαδικασία μη αυθόρμητος, μετασχηματιστής, τεχνητός μετασχηματισμός, βιομηχανίες, αλκαλικά μέταλλα, αλκαλική γη, αέριο υδρογόνο, αέριο cl