λέγεται δέσμη ιόντων το μέγεθος ενός ιόντος. Η μελέτη αυτής της ιδιότητας εξαρτάται από τη γνώση σχετικά με την ατομική ακτίνα και τα ιόντα.
Ατομική ακτίνα: είναι ένα μέτρο του μεγέθους ενός ουδέτερου ατόμου (θεωρητική απόσταση από τον πυρήνα έως την τελευταία ηλεκτρόσφαιρα).
ιόντα: άτομα που χάνουν (κατιόντα) ή αποκτούν ηλεκτρόνια (ανιόντα).
Πρωτόνια μέσα στον πυρήνα του α άτομο ασκήστε μια ελκυστική δύναμη στα ηλεκτρόνια (αρνητικά σωματίδια) που υπάρχουν στις ηλεκτροσφαίρες. Όσο μεγαλύτερος είναι ο αριθμός των πρωτονίων, τόσο μεγαλύτερη είναι αυτή η έλξη και το αντίστροφο. Όταν ο αριθμός ηλεκτρονίων σε ένα άτομο τροποποιείται με απώλεια ή αύξηση αυτών των σωματιδίων, η έλξη μεταξύ πρωτονίων και ηλεκτρονίων τροποποιείται ως εξής:
Στην περίπτωση κατιόντος:
Ο αριθμός των ηλεκτρονίων στις ηλεκτροσφαίρες γίνεται μικρότερος από τον αριθμό των πρωτονίων μέσα στον πυρήνα, το που κάνει τη δύναμη έλξης του πυρήνα μεγαλύτερη, προσελκύοντας τα ηλεκτρόνια πιο κοντά σε αυτόν. ηλεκτροσφαίρες. Το αποτέλεσμα είναι μια μείωση στην ακτίνα του ατόμου. Έτσι, η ακτίνα ενός κατιόντος θα είναι πάντα μικρότερη από την ακτίνα του ουδέτερου ατόμου του.
Ακτίνα ουδέτερου ατόμου> Ακτίνα κατιόντος
Στην περίπτωση ανιόντος:
Ο αριθμός των ηλεκτρονίων στα ηλεκτρόσφαιρα γίνεται μεγαλύτερος από τον αριθμό των πρωτονίων μέσα στον πυρήνα. Σε αυτήν την περίπτωση, η δύναμη έλξης που ασκείται από τον πυρήνα ξεπερνιέται από τη δύναμη απωθήσεως μεταξύ των ηλεκτρονίων που υπάρχουν στις ηλεκτροσφαίρες. Έτσι, η ακτίνα ενός ανιόντος θα είναι πάντα μεγαλύτερη από την ακτίνα του ουδέτερου ατόμου του.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Ακτίνα ανιόντων> Ακτίνα ουδέτερου ατόμου
Οι δύο καταστάσεις που παρουσιάζονται παρακάτω είναι ένα καλό παράδειγμα του τι συμβαίνει στην ακτίνα ενός ιόντος:
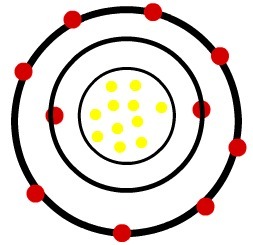
1ο) Ουδέτερο άτομο νατρίου (11Na) και το κατιόν νατρίου (11Στο+)
Ενώ το ουδέτερο άτομο νατρίου έχει έντεκα πρωτόνια (κίτρινες σφαίρες) και έντεκα ηλεκτρόνια (κόκκινες σφαίρες), το κατιόν νατρίου έχει έντεκα πρωτόνια και δέκα ηλεκτρόνια.

Μοντέλο ουδέτερου ατόμου νατρίου
Όταν το ουδέτερο άτομο νατρίου χάνει ένα ηλεκτρόνιο, η ακτίνα μειώνεται.
Μοντέλο κατιόντος νατρίου
Παρατήρηση: Το τρίτο επίπεδο δεν εκπροσωπήθηκε στην εικόνα του κατιόντος επειδή, καθώς έχασε το μόνο ηλεκτρόνιο που είχε, έγινε κενό και, ως εκ τούτου, αγνοήθηκε, αλλά είναι παρόν.
2ο) Ουδέτερο άτομο φωσφόρου (15Ρ) και το κατιόν φωσφόρου (15Π-3)
Ενώ το ουδέτερο άτομο φωσφόρου έχει δεκαπέντε πρωτόνια (κίτρινες σφαίρες) και δεκαπέντε ηλεκτρόνια (κόκκινες σφαίρες), το ανιόν φωσφόρου έχει δεκαπέντε πρωτόνια και δεκαοκτώ ηλεκτρόνια.
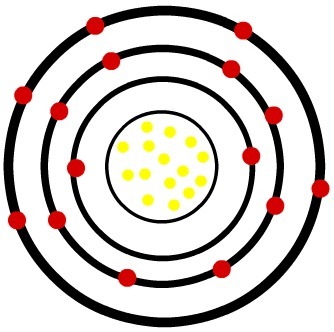
Μοντέλο ουδέτερου ατόμου φωσφόρου
Όταν το ουδέτερο άτομο φωσφόρου κερδίζει τρία ηλεκτρόνια, η ακτίνα αυξάνεται.
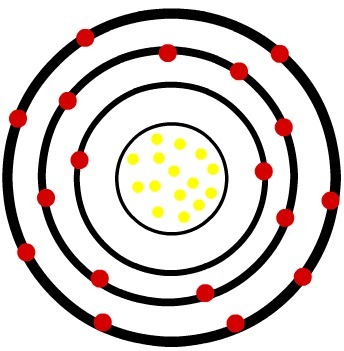
Μοντέλο ανιόντος του φωσφόρου
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Ιωνική ακτίνα"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/raio-ionico.htm. Πρόσβαση στις 28 Ιουνίου 2021.