Συνήθως οι αντιδράσεις του υδατική ηλεκτρόλυση και πύρινη ηλεκτρόλυση Πραγματοποιούνται με ηλεκτρόδια γραφίτη και πλατίνας, τα οποία δεν συμμετέχουν στην αντίδραση. διεξάγουν μόνο ηλεκτρικό ρεύμα. Ωστόσο, υπάρχουν ορισμένες συγκεκριμένες περιπτώσεις όπου είναι απαραίτητο να χρησιμοποιηθεί ενεργά ηλεκτρόδια, δηλαδή, υφίστανται μείωση και οξείδωση.
Οι κύριες περιπτώσεις χρήσης αυτών των ηλεκτροδίων που συμμετέχουν στη διαδικασία οξειδοαναγωγής είναι: α ηλεκτρολυτικός καθαρισμός μετάλλων, όπως ψευδάργυρος, κοβάλτιο, νικέλιο και ειδικά χαλκός. και επίσης το ηλεκτρολυτική επιμετάλλωση. Ας δούμε πώς συμβαίνει κάθε περίπτωση:
• Ηλεκτρολυτικός καθαρισμός χαλκού: αυτή η ηλεκτρολυτική διύλιση χαλκού μπορεί να παράγει καθαρότητα περίπου 99,9% και χρησιμοποιείται κυρίως για την παραγωγή σύρματα χαλκού τα οποία, εάν έχουν τη μικρότερη ποσότητα ακαθαρσίας, μπορεί να έχουν την ικανότητά τους να μεταφέρουν πολύ ηλεκτρικό ρεύμα μειώθηκε.
Παρατηρήστε πώς πραγματοποιείται αυτή η διαδικασία, βλέποντας το σχήμα ενός ηλεκτρολυτικού κάδου που συναρμολογείται παρακάτω:

Εφαρμόζεται διαφορά δυναμικού στο υδατικό διάλυμα θειικού χαλκού (CuSo4 (υδ)) - που μεταφέρει ηλεκτρισμό - έτσι ώστε η άνοδος, που είναι ένας ακάθαρτος μεταλλικός χαλκός, να χάσει ηλεκτρόνια, δηλαδή να υποστεί οξείδωση, απελευθερώνοντας τα κατιόντα2+), τα οποία εναποτίθενται στην αρνητική πλάκα. Αυτό θα μπορούσε να είναι μια αδρανή πλάκα πλατίνας ή, καλύτερα, μια καθαρή πλάκα χαλκού. Αποτελεί την κάθοδο, η οποία μειώνεται καθώς εναποτίθεται χαλκός. Έτσι, οι ημι-αντιδράσεις που εμφανίζονται στα ηλεκτρόδια είναι:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
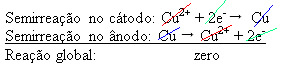
Το γεγονός ότι έδωσε μηδενικό αποτέλεσμα δείχνει ότι δεν υπήρχε χημική αντίδραση, αλλά μόνο η μεταφορά χαλκού. Στο κάτω μέρος του δοχείου βρίσκονται οι άλλες ακάθαρτες ουσίες που ήταν σε χαλκό, όπως χρυσός, ασήμι, σίλικα (άμμος) και άλλα ορυκτά, τα οποία μπορούν ακόμη και να πωληθούν.
• Ηλεκτρολυτική επιμετάλλωση: εφαρμόζεται μεταλλική επίστρωση σε υλικό που προστατεύεται από τη διάβρωση.
Το μέταλλο που επιλέγεται για την επίστρωση - το οποίο μπορεί να είναι χρώμιο (χρώμιο), νικέλιο (νικέλιο), ασήμι (ασήμι), χρυσός (επιχρύσωση) ή ψευδάργυρος (γαλβανισμός) - θα είναι η άνοδος, θετικό ηλεκτρόδιο, το οποίο υφίσταται οξείδωση, χάνοντας ηλεκτρόνια. Υποβάλλεται σε οξείδωση στη θέση του υλικού που έχει προστατευτεί, επειδή το δυναμικό μείωσής του είναι μεγαλύτερο.
Το αρνητικό ηλεκτρόδιο, δηλαδή η κάθοδος, η οποία δέχεται αυτά τα ηλεκτρόνια και υφίσταται αναγωγή, είναι το ίδιο το υλικό που επικαλύφθηκε. Με αυτόν τον τρόπο, παραμένει προστατευμένο ακόμα και αν η επιφάνειά του έχει παραβιαστεί.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Ηλεκτρόλυση με ενεργά ηλεκτρόδια". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm. Πρόσβαση στις 28 Ιουνίου 2021.


