Ο εξίσωση clapeyron είναι μια μαθηματική έκφραση που σχετίζεται με ποσότητες όπως πίεση (P), όγκος (V), θερμοκρασία (T) και αριθμός σωματιδίων (n) που απαρτίζουν a τέλειο ή ιδανικό αέριο. Αυτή η εξίσωση πήρε το όνομά της από τον Γάλλο φυσικό ΠαύλοςEmileclapeyron και μπορεί να γίνει κατανοητό ως γενίκευση των εμπειρικών νόμων του αέριατέλειοςσεGay-Lussac, Charles και Boyle. Ήταν θεμελιώδες για τη μελέτη των ιδανικών αερίων και επέτρεψε την εξέλιξη του Θερμικές μηχανές, καθιστώντας τα όλο και πιο αποτελεσματικά τις τελευταίες δεκαετίες.
Δείτε επίσης: Ανακαλύψεις φυσικής που συνέβησαν από ατύχημα
Εξίσωση Clapeyron: ιδανικός νόμος για το φυσικό αέριο
Η εξίσωση του Clapeyron είναι προέρχεται από τρεις εμπειρικούς νόμους, δηλαδή, νόμοι που καθορίστηκαν από πειράματα. Τέτοιοι νόμοι εξηγούν τη συμπεριφορά των αερίων στο μετασχηματισμοί αερίουισοογκομετρική (Νόμος Gay-Lussac), ισοβαρής (Νόμος του Καρόλου) και ισόθερμοι (Νόμος του Boyle). Σύμφωνα με αυτούς τους νόμους:
στους μετασχηματισμούς ισοογκομετρική
, η αναλογία μεταξύ πίεσης και θερμοδυναμικής θερμοκρασίας ενός ιδανικού αερίου παραμένει σταθερή.στους μετασχηματισμούς ισοβαρής, η αναλογία μεταξύ του όγκου και της θερμοδυναμικής θερμοκρασίας ενός ιδανικού αερίου είναι σταθερή ·
- στους μετασχηματισμούς ισόθερμοι, το προϊόν της πίεσης και του όγκου ενός ιδανικού αερίου παραμένει σταθερό.
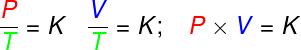
Π - πίεση (Pa - pascal)
Β - όγκος αερίου (m³)
Τ - Θερμοδυναμική θερμοκρασία αερίου (K - kelvin)
Από τους τρεις παραπάνω νόμους, η εξίσωση Clapeyron καθορίζει ποια είναι η αξία αυτού συνεχής (κ) που λαμβάνονται σε κάθε έναν από τους προαναφερθέντες μετασχηματισμούς. Σύμφωνα με την εξίσωση του Clapeyron, αυτή η σταθερά ισούται με τον αριθμό γραμμομορίων πολλαπλασιασμένο επί a σταθερά R, γνωστή ως η καθολική σταθερά ιδανικών αερίων, και ίση με Σταθερή Boltzmann πολλαπλασιασμένο επί Αριθμός Avogadro.
Τύπος
Δείτε τον τύπο που είναι γνωστός ως εξίσωσησεClapeyron:
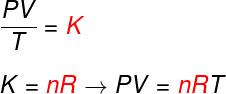
όχι - αριθμός γραμμομορίων (mol)
Ρ - καθολική σταθερά ιδανικών αερίων (R = 0,082 atm.l / mol. Κ ή 8.314 J. mol / K)
Αναλύοντας την εξίσωση Clapeyron, είναι δυνατόν να δούμε ότι το πίεση ασκείται από ιδανικά αέρια είναι άμεσα ανάλογη με τη θερμοκρασία και επίσης αριθμός γραμμομορίων. Επί πλέον, Η πίεση είναι αντιστρόφως ανάλογη προς τον όγκο καταλαμβάνεται από αέριο.
Ο ιδανικό μοντέλο αερίου κατέστη δυνατή από την εξίσωση Clapeyron χρησιμοποιείται ευρέως για το ανάπτυξη μηχανών που τροφοδοτούνται από υγρά, όπως ατμοκίνητα μηχανήματα και κινητήρες εσωτερικής καύσης.
Διάφορα σημαντικά αποτελέσματα θα μπορούσαν να ληφθούν από την εξίσωση Clapeyron. Ένα από αυτά, για παράδειγμα, προβλέπει ότι 1 mole οποιουδήποτε ιδανικού αερίου καταλαμβάνει όγκο 22,4 λίτρα όταν υφίσταται πίεση 1 ατμ (1,01.105 Pa) και στη θερμοκρασία 273 χιλ (0 ° C).
Δείτε επίσης: Οι σημαντικότερες έννοιες στη Θερμολογία
Επιλυμένες ασκήσεις στην εξίσωση Clapeyron
Ερώτηση 1 - (UECE) Ένα αέριο που μπορεί να σχετίζεται με τη θερμοκρασία, τον όγκο και την πίεση από PV = nRT έχει τα ακόλουθα χαρακτηριστικά:
α) πολύ μεγάλη μέση απόσταση μεταξύ των μορίων προκειμένου να αγνοηθούν οι διαμοριακές αλληλεπιδράσεις, εκτός από τη σύγκρουση · τα μόρια υφίστανται ελαστικές συγκρούσεις.
β) πολύ μικρή μέση απόσταση μεταξύ μορίων · τα μόρια υφίστανται ανελαστικές συγκρούσεις.
γ) πολύ μεγάλη μέση απόσταση μεταξύ των μορίων προκειμένου να αγνοηθούν οι διαμοριακές αλληλεπιδράσεις, εκτός από τη σύγκρουση · τα μόρια υφίστανται ανελαστικές συγκρούσεις.
δ) πολύ μεγάλη μέση απόσταση μεταξύ των μορίων και με ισχυρές διαμοριακές αλληλεπιδράσεις. τα μόρια υφίστανται ελαστικές συγκρούσεις.
Ανάλυση:
Στο ιδανικό μοντέλο αερίου, ένας μεγάλος αριθμός σωματιδίων χωρίς διάσταση κινούνται με υψηλή ταχύτητα σε τυχαίες κατευθύνσεις. Η μόνη αλληλεπίδραση που υφίστανται αυτά τα σωματίδια είναι απόλυτα ελαστικές συγκρούσεις, οπότε η σωστή εναλλακτική λύση είναι γράμμα Α.
Ερώτηση 2 - (UFRGS) Εξετάστε τις ακόλουθες δηλώσεις σχετικά με τα ιδανικά αέρια.
ΕΓΩ. Η σταθερά R που υπάρχει στην εξίσωση της κατάστασης για τα αέρια pV = nRT έχει την ίδια τιμή για όλα τα ιδανικά αέρια.
ΙΙ. Ίσοι όγκοι διαφορετικών ιδανικών αερίων, στην ίδια θερμοκρασία και πίεση, περιέχουν τον ίδιο αριθμό μορίων.
III. Η μέση κινητική ενέργεια των μορίων ενός ιδανικού αερίου είναι άμεσα ανάλογη με την απόλυτη θερμοκρασία του αερίου.
Ποια είναι σωστά;
α) Μόνο εγώ
β) Μόνο II
γ) Μόνο III
δ) Μόνο τα I και II
ε) I, II και III
Πρότυπο:
Ας δούμε τις εναλλακτικές λύσεις:
ΕΓΩ. σωστός, Ως εκ τούτου ονομάζεται η καθολική σταθερά ιδανικών αερίων.
ΙΙ. σωστός. Σύμφωνα με την εξίσωση του Clapeyron, εάν δύο ιδανικά αέρια έχουν την ίδια πίεση, θερμοκρασία και όγκο, τότε ο αριθμός των σωματιδίων σε αυτά τα αέρια είναι ίσος.
III. σωστός. Σύμφωνα με το θεώρημα του ισοδύναμου ενέργειας, η κινητική ενέργεια των σωματιδίων σε ένα ιδανικό αέριο είναι ανάλογη της θερμοκρασίας του.
Επομένως, η σωστή εναλλακτική λύση είναι η γράμμα ε.
Ερώτηση 3 - (UFJFΆνδρες όπως οι Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, μεταξύ άλλων, έχουν αναπτύξει σημαντικές μελέτες που αφορούν τις ιδιότητες των αερίων. Η συμπεριφορά των πραγματικών αερίων προσεγγίζει τα ιδανικά αέρια σε συνθήκες χαμηλής πίεσης, καθώς και τα αέρια που περιέχονται σε μεγάλο όγκο και τα αέρια που διατηρούνται σε υψηλές θερμοκρασίες. Λάβετε υπόψη ότι, σε ένα εργαστηριακό πείραμα, ένα δοχείο του όγκου V είναι εντελώς κλειστό και περιέχει 1 mol ιδανικού αερίου υπό πίεση 4,0. το atm υπόκειται σε διαστολή σε σταθερή θερμοκρασία ίση με 127 127 C και ότι η συμπεριφορά αυτού του αερίου είναι αυτή του ιδανικού αερίου, όπως φαίνεται στο γραφικός.
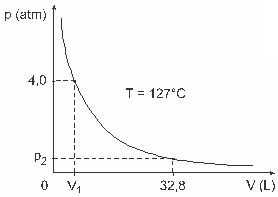
Σε αυτήν την περίπτωση, όταν το αέριο καταλαμβάνει όγκο ίσο με 32,8 L, η πίεση που ασκείται από αυτό θα είναι:
(Δεδομένου: η καθολική σταθερά τέλειων αερίων είναι R = 0,082 atm. L / mol. Κ.)
α) 0,32 atm
β) 0,40 atm
γ) 1,0 atm
δ) 2,0 atm
ε) 2,6 atm
Ανάλυση:
Γράμμα Γ.
Για να λύσουμε την άσκηση, πρέπει να εφαρμόσουμε τα δεδομένα στην εξίσωση Clapeyron, αλλά πριν από αυτό πρέπει να μετατρέψουμε τη θερμοκρασία, η οποία είναι σε βαθμούς Κελσίου, σε kelvin. Ολοκλήρωση παραγγελίας:

Από τον Rafael Hellerbock
Καθηγητής φυσικής
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm
