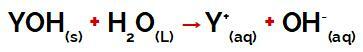Ο σταθερά υδρόλυσης (Kh) αναφέρεται σε ένα χημική ισορροπία προσδιορίζεται από την υδρόλυση ενός άλατος (χημική αντίδραση που περιλαμβάνει ένα διαλυτό άλας και νερό).
Ως σταθερά οποιασδήποτε άλλης ισορροπίας, η έκφραση του σταθερά υδρόλυσης κατασκευάζεται από το προϊόν των συγκεντρώσεων προϊόντος διαιρούμενο με το προϊόν των συγκεντρώσεων αντιδραστηρίου, ως εξής:
Χ = [προϊόντα]
[αντιδραστήρια]
Η εργασία με τη σταθερά υδρόλυσης περιλαμβάνει γνώση τριών σημαντικών φαινομένων:
- Διαχωρισμός αλάτων;
- Ιονισμός νερού;
- Υδρόλυση αλατιού
Διαχωρισμός αλάτων
Όταν ένα διαλυτό άλας προστίθεται στο νερό, διαχωρίζεται και απελευθερώνει κατιόν διαφορετικό από το υδροδόνιο (Η +) και ανιόν εκτός του υδροξυλίου (ΟΗ-).

Για να σας υπενθυμίσω πότε ένα αλάτι είναι ή δεν είναι διαλυτό στο νερό, Κάντε κλικ ΕΔΩ και μελετήστε τον πίνακα διαλυτότητας σε αλάτι.
ιονισμός νερού
Το νερό είναι μια ουσία που υφίσταται φυσικά το φαινόμενο αυτο-ιονισμού, δηλαδή παράγει κατιόν υδρονίου και ανιόν υδροξυλίου.
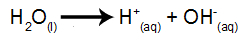
εξίσωση ιονισμού νερού
υδρόλυση ενός άλατος
Ως διαλυτό άλας απελευθερώνει ιόντα στο νερό και το νερό υφίσταται ιονισμό, παράγοντας ιόντα στη μέση, μπορεί να λάβει χώρα η αντίδραση (υδρόλυση) μεταξύ των ιόντων αλατιού και των ιόντων νερού. Όταν συμβαίνει αυτή η αντίδραση, οι πιθανές αλληλεπιδράσεις είναι:
- Κατιόν του άλατος με το ανιόν του νερού (σχηματισμός βάσης).
- Ανιόν αλάτι με κατιόν νερού (σχηματισμός αλατιού).
Οι παραπάνω αλληλεπιδράσεις θα συμβούν μόνο εάν η βάση ή το οξύ που σχηματίζεται είναι ασθενές.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Δείτε ένα παράδειγμα της υδρόλυσης ενός άλατος:
→ Υδρόλυση υποχλωριώδους αμμωνίου (NH4ClO)
Όταν προστίθεται υποχλωριώδες αμμώνιο στο νερό, διαλύεται και αποσυντίθεται, απελευθερώνοντας τα κατιόντα ιόντων αμμωνίου (NH4 +) και το υποχλωριώδες ανιόν (ClO-):

Εξίσωση που δείχνει τα ιόντα που απελευθερώνονται κατά τη διάσταση του υποχλωριώδους αμμωνίου
Καθώς το νερό, όταν υποβάλλεται σε ιονισμό, παράγει Η + και ΟΗ-, έχουμε στο διάλυμα δύο κατιόντα και δύο ανιόντα, τα οποία μπορούν να αντιδράσουν. Το κατιόν NH4 + αντιδρά μόνο με το ΟΗ-ανιόν διότι σχηματίζει μια ασθενή βάση (NH4OH). Το Clion αντιδρά μόνο με το κατιόν H + επειδή σχηματίζει ένα ασθενές οξύ (HClO).

Εξίσωση ισορροπίας υδρόλυσης υποχλωριώδους αμμωνίου
Κατασκευή της έκφρασης της σταθεράς υδρόλυσης
Η κατασκευή της σταθεράς υδρόλυσης ενός άλατος εξαρτάται αποκλειστικά από την εξίσωση υδρόλυσης για αυτό το άλας. Η υδρόλυση του υποχλωριώδους αμμωνίου, για παράδειγμα, που επεξεργάστηκε στο προηγούμενο στοιχείο, δημιούργησε την ακόλουθη εξίσωση:

Εξίσωση ισορροπίας υδρόλυσης υποχλωριώδους αμμωνίου
Πώς να φτιάξετε την έκφραση του σταθερά υδρόλυσης λαμβάνει υπόψη προϊόντα και αντιδραστήρια, η έκφραση της σταθεράς θα ήταν:
Χ = [HClO]. [NH4OH]
[ClO -]. [NH4 +]
ΣΗΜΕΙΩΣΗ: Το νερό δεν συμμετέχει στην εξίσωση επειδή είναι υγρό αντιδραστήριο και επίσης επειδή είναι το θεμελιώδες μέσο για την εμφάνιση υδρόλυσης, δηλαδή είναι σταθερό.
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Τι είναι μια σταθερά υδρόλυσης;"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm. Πρόσβαση στις 28 Ιουνίου 2021.
Τι είναι η χημεία;

Κατανοήστε τι είναι το Kp, η σταθερά ισορροπίας ως προς την πίεση και μάθετε πώς να το αποκτήσετε χρησιμοποιώντας πιέσεις μερίδια όλων των αερίων που υπάρχουν σε χημική ισορροπία, η οποία μπορεί να είναι σε ατμόσφαιρες (atm) ή χιλιοστά υδραργύρου (mmHg). Κάντε κλικ εδώ και μάθετε περισσότερα για αυτό το θέμα!
Χημεία

Δοκιμάστε τις γνώσεις σας και μάθετε περισσότερα με αυτόν τον κατάλογο λύσεων για χημικές ισορροπίες. Μέσω αυτού του υλικού, θα είστε σε θέση να κατανοήσετε καλύτερα πώς να εργάζεστε σταθερές ισορροπίας (Kp, Kc και Ki), μετατόπιση ισορροπίας, pH και pOH, καθώς και ισορροπία σε λεγόμενες ρυθμιστικές λύσεις.