Για να συμβεί μια χημική αντίδραση, είναι απαραίτητο να ικανοποιηθούν τέσσερις βασικές προϋποθέσεις, οι οποίες είναι:
1. Τα αντιδραστήρια πρέπει να επικοινωνήσουν.
2. Πρέπει να υπάρχει χημική συγγένεια μεταξύ των αντιδραστηρίων.
3. Οι συγκρούσεις μεταξύ σωματιδίων αντιδραστηρίου πρέπει να είναι αποτελεσματικές.
4. Πρέπει να επιτευχθεί ενέργεια ενεργοποίησης.
Εν συντομία δείτε κάθε περίπτωση:
1.Επαφή μεταξύ αντιδραστηρίων:
Αυτή η κατάσταση είναι προφανής, διότι ακόμη και αν τα αντιδραστήρια έχουν πολλή συγγένεια μεταξύ τους, όπως στην περίπτωση των οξέων και των βάσεων, εάν διαχωρίζονται, η αντίδραση δεν θα συμβεί. Πρέπει να έρθουν σε επαφή έτσι ώστε τα σωματίδια τους να συγκρούονται, σπάζοντας τους δεσμούς των αντιδρώντων και σχηματίζοντας τους δεσμούς των προϊόντων.

2.Χημική συγγένεια:
Όπως είδαμε, η επαφή των αντιδραστηρίων είναι απαραίτητη, αλλά όχι αρκετή. Για παράδειγμα, εάν βάλουμε το νάτριο σε επαφή με νερό, θα προκύψει μια εξαιρετικά βίαιη αντίδραση, αλλά αν βάλουμε χρυσό, δεν θα δούμε καμία διαφορά. Αυτό συμβαίνει επειδή διαφορετικές ουσίες έχουν διαφορετική χημική συγγένεια μεταξύ τους ή μπορεί να μην έχουν καμία συγγένεια. Όσο μεγαλύτερη είναι η χημική συγγένεια, τόσο πιο γρήγορη είναι η αντίδραση.
Στα παραδείγματα που αναφέρθηκαν, το νάτριο έχει μεγάλη συγγένεια με το νερό, τόσο ώστε, ώστε να μην έρθει σε επαφή με την υγρασία στον αέρα, το μεταλλικό νάτριο αποθηκεύεται σε κηροζίνη. Ο χρυσός είναι αδρανής, γι 'αυτό τα χρυσά μνημεία διαρκούν τόσο πολύ, όπως οι σαρκοφάγοι της Αιγύπτου.

3.Θεωρία σύγκρουσης:
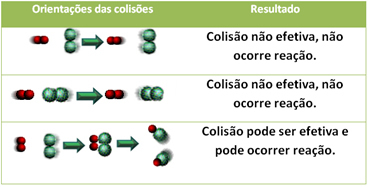
Ακόμη και σε ενώσεις που έχουν χημική συγγένεια, για να προχωρήσει η αντίδραση είναι απαραίτητο τα σωματίδια, τα άτομα ή τα μόριά τους να συγκρούονται αποτελεσματικά. Όχι όλα τα σωματίδια που συγκρούονται το κάνουν αποτελεσματικά, αλλά τα σοκ που οδηγούν στο σπάσιμο του δεσμοί αντιδραστηρίων και σχηματισμός νέων δεσμών είναι εκείνοι που εμφανίζονται στον σωστό προσανατολισμό και με την ενέργεια αρκετά.
Παρακάτω φαίνεται η περίπτωση δύο αναποτελεσματικών συγκρούσεων και μιας αποτελεσματικής σύγκρουσης που έχει ως αποτέλεσμα την αντίδραση.
4.Ενέργεια ενεργοποίησης και ενεργοποιημένο σύμπλεγμα:
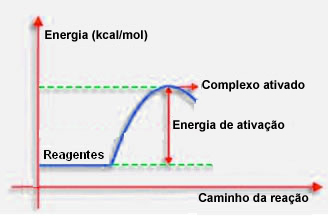
Όπως αναφέρθηκε στο προηγούμενο σημείο, η αποτελεσματική σύγκρουση, εκτός από την ευνοϊκή καθοδήγηση, χρειάζεται επίσης αρκετή ενέργεια. Η ελάχιστη ποσότητα ενέργειας που απαιτείται για κάθε αντίδραση που λαμβάνει χώρα ονομάζεται ενέργεια ενεργοποίησης.
Εάν τα αντιδραστήρια έχουν ενέργεια ίση ή μεγαλύτερη από την ενέργεια ενεργοποίησης, κατά τη διάρκεια του καλά προσανατολισμένου σοκ, Ένα αρχικά ενεργοποιημένο σύμπλοκο θα σχηματιστεί, το οποίο είναι μια ενδιάμεση δομή μεταξύ των αντιδρώντων και του προϊόντα. Στο ενεργοποιημένο σύμπλεγμα, υπάρχουν εξασθενημένοι δεσμοί αντιδραστηρίων και σχηματίζονται νέοι δεσμοί προϊόντος.
Έτσι, η ενέργεια ενεργοποίησης λειτουργεί ως ένα είδος φραγμού για την εμφάνιση της αντίδρασης, επειδή όσο μεγαλύτερη είναι, τόσο πιο δύσκολη θα είναι η αντίδραση. Σε ορισμένες περιπτώσεις, είναι απαραίτητο να παρέχεται ενέργεια στα αντιδραστήρια. Για παράδειγμα, το αέριο μαγειρέματος έχει συγγένεια να αλληλεπιδρά με το οξυγόνο στον αέρα, αλλά πρέπει να παρέχουμε ενέργεια όταν φέρνουμε τον αγώνα μαζί, διαφορετικά η αντίδραση δεν λαμβάνει χώρα. Αλλά μόλις ξεκίνησε, η ίδια η αντίδραση απελευθερώνει αρκετή ενέργεια για να ενεργοποιήσει τα άλλα μόρια και να συνεχίσει την αντίδραση.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm

