Υπάρχει ένας κλάδος της επιστήμης που μελετά την ταχύτητα των χημικών αντιδράσεων και τους παράγοντες που την επηρεάζουν, ονομάζεται Chemical Kinetics. Οι χημικές αντιδράσεις μπορούν να οριστούν ως ένα σύνολο φαινομένων στα οποία δύο ή περισσότερες ουσίες αντιδρούν μεταξύ τους, δημιουργώντας διαφορετικές ενώσεις. Μια χημική εξίσωση είναι μια γραφική παράσταση μιας χημικής αντίδρασης, όπου τα αντιδραστήρια εμφανίζονται στο πρώτο μέλος και τα προϊόντα στο δεύτερο.
Α + Β  Γ + Δ
Γ + Δ
Προϊόντα αντιδραστηρίων
Η γνώση και η μελέτη των αντιδράσεων, εκτός από το ότι είναι πολύ σημαντικές σε βιομηχανικούς όρους, σχετίζονται επίσης με την καθημερινή μας ζωή.
Η ταχύτητα μιας αντίδρασης είναι το πόσο γρήγορα καταναλώνονται τα αντιδραστήρια ή πόσο γρήγορα σχηματίζονται τα προϊόντα. Το κάψιμο ενός κεριού και ο σχηματισμός σκουριάς είναι παραδείγματα αργών αντιδράσεων. Στον δυναμίτη, η αποσύνθεση της νιτρογλυκερίνης είναι μια ταχεία αντίδραση.
Οι ταχύτητες των χημικών αντιδράσεων καθορίζονται μέσω εμπειρικών νόμων, που ονομάζονται νόμοι του ταχύτητα, που προκύπτει από την επίδραση της συγκέντρωσης αντιδραστηρίων και προϊόντων στην ταχύτητα αντίδραση.
Οι χημικές αντιδράσεις εμφανίζονται σε διαφορετικές ταχύτητες και αυτές μπορούν να αλλάξουν, διότι εκτός από συγκέντρωση αντιδρώντων και προϊόντων, οι ρυθμοί αντίδρασης εξαρτώνται επίσης από άλλους παράγοντες σαν:
Συγκέντρωση αντιδραστηρίου: όσο υψηλότερη είναι η συγκέντρωση των αντιδρώντων, τόσο πιο γρήγορα θα είναι η αντίδραση. Για να πραγματοποιηθεί αντίδραση μεταξύ δύο ή περισσότερων ουσιών, είναι απαραίτητο τα μόρια να συγκρούονται, έτσι ώστε να υπάρχει ρήξη στους δεσμούς με τον επακόλουθο σχηματισμό νέων. Ο αριθμός των συγκρούσεων εξαρτάται από τις συγκεντρώσεις των Α και Β. Δείτε την εικόνα:
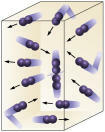
Τα μόρια συγκρούονται πιο συχνά εάν
αυξάνουμε τον αριθμό των μορίων αντίδρασης.
Είναι εύκολο να δούμε ότι λόγω υψηλότερης συγκέντρωσης θα υπάρξει αύξηση των συγκρούσεων μεταξύ μορίων.
επιφάνεια επαφής: μια αύξηση στην επιφάνεια επαφής αυξάνει την ταχύτητα αντίδρασης. Ένα παράδειγμα είναι όταν διαλύουμε ένα θρυμματισμένο δισκίο sonrisal και διαλύεται γρηγορότερα από ό, τι αν ήταν ολόκληρο, αυτό συμβαίνει επειδή αυξάνουμε την επιφάνεια επαφής που αντιδρά με το Νερό.
Πίεση: όταν αυξάνετε την πίεση ενός αερίου συστήματος, αυξάνεται η ταχύτητα αντίδρασης.
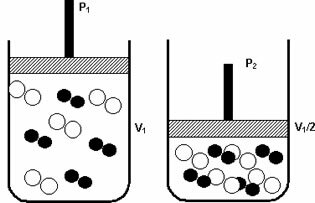
Η αύξηση της πίεσης από P1 σε P2 μείωσε τον όγκο από V1 σε V1 / 2, επιταχύνοντας την αντίδραση λόγω της προσέγγισης των μορίων.
Το παραπάνω σχήμα επεξηγεί, όπως με τη μείωση του όγκου στο δεύτερο δοχείο, θα υπάρξει αύξηση στο πίεση που εντείνει τις συγκρούσεις των μορίων και κατά συνέπεια μια αύξηση στην ταχύτητα του αντίδραση.
Θερμοκρασία: όταν η θερμοκρασία ενός συστήματος αυξάνεται, υπάρχει επίσης αύξηση του ρυθμού αντίδρασης. Αύξηση της θερμοκρασίας σημαίνει αύξηση της κινητικής ενέργειας των μορίων. Στις μέρες μας, μπορούμε να παρατηρήσουμε αυτόν τον παράγοντα όταν μαγειρεύουμε και αυξάνουμε τη φλόγα της σόμπας έτσι ώστε το φαγητό να φτάσει στον βαθμό μαγειρέματος πιο γρήγορα.
Καταλύτες: Οι καταλύτες είναι ουσίες που επιταχύνουν τον μηχανισμό χωρίς να μεταβάλλονται μόνιμα, δηλαδή κατά τη διάρκεια της αντίδρασης δεν καταναλώνονται. Οι καταλύτες επιτρέπουν στην αντίδραση να λάβει μια εναλλακτική διαδρομή, η οποία απαιτεί λιγότερη ενέργεια ενεργοποίησης, προκαλώντας την αντίδραση να προχωρήσει πιο γρήγορα. Είναι σημαντικό να θυμόμαστε ότι ένας καταλύτης επιταχύνει την αντίδραση, αλλά δεν αυξάνει την απόδοση, δηλαδή παράγει την ίδια ποσότητα προϊόντος, αλλά σε μικρότερο χρονικό διάστημα.
Από τη Lria Alves
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm