Ο γωνιακή γεωμετρία είναι ένας από τους διάφορους τύπους μοριακή γεωμετρία, που μπορεί ακόμα να είναι γραμμική, πυραμιδική, επίπεδη τριγωνική, τετράεδρος, και τα λοιπά. Η γωνιακή γεωμετρία μπορεί να βρεθεί μόνο σε μόρια που έχουν τα ακόλουθα χαρακτηριστικά:
Τριατομική, δηλαδή, έχουν μόνο τρία άτομα.
Έχετε τουλάχιστον τρία σύννεφα ηλεκτρονίων στο κεντρικό άτομο.
Σημείωση: το ηλεκτρονικό σύννεφο είναι το παν ομοιοπολικό δεσμό (μονό, διπλό, τριπλό ή συντεταγμένο) μεταξύ ατόμων και ηλεκτρονίων ζευγών του στρώμα σθένους που δεν συμμετέχουν σε μια κλήση.
Δείτε μερικά παραδείγματα μορίων που έχουν γωνιακή γεωμετρία:
1ο Παράδειγμα: νερό (Η2Ο)

συμβατική δομή νερού
Στη δομή του νερού, έχουμε:
Τρία άτομα: δύο υδρογόνα και ένα οξυγόνο.
Το οξυγόνο είναι το κεντρικό άτομο επειδή δημιουργεί μεγαλύτερο αριθμό δεσμών (δύο, καθώς ανήκει στην οικογένεια VIA).
Δύο απλοί δεσμοί μεταξύ οξυγόνου και υδρογόνων. Αυτό συμβαίνει επειδή κάθε υδρογόνο μπορεί να κάνει μόνο έναν δεσμό και ένα οξυγόνο δύο δεσμούς.
Τέσσερα μη συνδεδεμένα ηλεκτρόνια σε οξυγόνο, καθώς έχει έξι ηλεκτρόνια στο κέλυφος σθένους και χρησιμοποιεί μόνο δύο στους δεσμούς.
Ως εκ τούτου, όπως στο μόριο νερού υπάρχουν τρία άτομα και τέσσερα ηλεκτρονικά σύννεφα (δύο μονό δεσμοί και δύο ζεύγη ηλεκτρονίων που δεν συνδέονται) στο κεντρικό άτομο, το η γεωμετρία είναι γωνιακή.
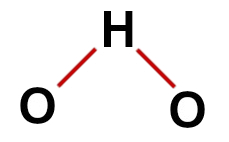
Σωστή δομική φόρμουλα νερού
Σημείωση: Όποτε το μόριο παρουσιάζει αυτά τα σχήματα, η γωνία που σχηματίζεται μεταξύ των ατόμων είναι περίπου 109-28'.
2ο Παράδειγμα: Διοξείδιο του θείου (SO2)

Συμβατική δομή διοξειδίου του θείου
Στη δομή του διοξειδίου του θείου, έχουμε:
Τρία άτομα: δύο οξυγόνα και ένα άτομο θείου.
Το θείο είναι το κεντρικό άτομο καθώς είναι το μικρότερο στοιχείο στο μόριο, καθώς όλα τα στοιχεία πρέπει να κάνουν τον ίδιο αριθμό δεσμών (δύο).
Ένας διπλός δεσμός μεταξύ θείου και ενός από τα οξυγόνα. Αυτό συμβαίνει επειδή και οι δύο χρειάζονται δύο συνδέσεις.
Ενας συντεταγμένος ή γενικός ομοιοπολικός δεσμός, επειδή το θείο ήταν σταθερό μετά τη σύζευξη με το άλλο οξυγόνο, αλλά εξακολουθεί να υπάρχει ένα άτομο οξυγόνου που χρειάζεται δύο ηλεκτρόνια.
Τέσσερα μη δεσμευτικά ηλεκτρόνια σε οξυγόνο. Αυτό συμβαίνει επειδή το οξυγόνο έχει έξι ηλεκτρόνια στο κέλυφος σθένους και χρησιμοποιεί μόνο δύο στους δεσμούς.
Έτσι, όπως στο μόριο του διοξειδίου του θείου υπάρχουν τρία άτομα και τέσσερα ηλεκτρονικά σύννεφα (δύο μονά δεσμοί και δύο ζεύγη μη συνδεδεμένων ηλεκτρονίων) στο κεντρικό άτομο, το η γεωμετρία είναι γωνιακή.
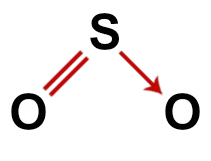
Σωστός συντακτικός τύπος διοξειδίου του θείου
Σημείωση: Όποτε το μόριο έχει αυτά τα σχήματα, η γωνία που σχηματίζεται μεταξύ των ατόμων είναι περίπου 120Ο.
Από μένα. Diogo Lopes Dias
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm

