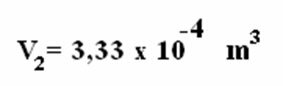Αέριοιδανικό είναι αυτό όπου το συγκρούσεις μεταξύ των σωματιδίων είναι απόλυτα ελαστικά. Μεταξύ των σωματιδίων του, δεν υπάρχει κανένα είδος αλληλεπίδρασης, όπως δυνάμεις ελκυστικό ή απωθητικό, επιπλέον, αυτά τα σωματίδια δεν καταλαμβάνουν χώρο.
Σύμφωνα με την κινητική θεωρία των αερίων, η θερμοδυναμική κατάσταση ενός ιδανικού αερίου περιγράφεται πλήρως από τις μεταβλητές του πίεση, όγκος και θερμοκρασία.
Κοίταεπίσης: Θερμιδομετρία: χάρτης μυαλού, τύποι και λύσεις
ιδανική έννοια αερίου
Τα ιδανικά αέρια αποτελούνται αποκλειστικά από σωματίδιασεδιαστάσειςακριβής (αμελητέου μεγέθους) που βρίσκονται σε κίνησηχαώδης είναι αναμμένο υψηλόςταχύτητα. Σε αυτόν τον τύπο αερίου, η θερμοκρασία και η ταχύτητα μετάφρασης των σωματιδίων είναι ανάλογες.
Δεδομένου ότι δεν υπάρχει αλληλεπίδραση μεταξύ των σωματιδίων ενός ιδανικού αερίου, το εσωτερική ενέργεια αυτού του αερίου είναι πάντα ίσο με το άθροισμα του κινητική ενέργεια όλων των σωματιδίων που το αποτελούν.

Όποια κι αν είναι τα ιδανικά αέρια, θα έχουν πάντα τα ίδια αριθμόςσεσωματίδια για τον ίδιο τόμο. Η μάζα τους, με τη σειρά της, θα εξαρτηθεί άμεσα από τη δική σας μοριακή μάζα (μετρούμενη σε g / mol), επιπλέον, 1 γραμμάριο ιδανικού αερίου (περίπου 6.0.1023 σωματίδια) θα καταλαμβάνουν πάντα a όγκος ίσος με 22,4 l.
Εσείς αέριαπραγματικός, όπου υπάρχει εμφάνιση συγκρούσειςόχι ελαστικός μεταξύ των σωματιδίων, έρχονται πολύ κοντά στη συμπεριφορά των ιδανικών αερίων συστήματα χαμηλής πίεσης και υψηλής θερμοκρασίας. Συμπτωματικά, υπό κανονικές συνθήκες πίεσης και θερμοκρασίας στη Γη (25 ° C και 1 atm), το μεγαλύτερο μέρος του Τα αέρια συμπεριφέρονται σαν ιδανικά αέρια και αυτό διευκολύνει τον υπολογισμό των προβλέψεων σχετικά με τη θερμοδυναμική συμπεριφορά δικα τους.
Μερικά αέρια, όπως το υδρατμος, που αραιώνεται στο ατμοσφαιρικό αέριο, δεν μπορούν να θεωρηθούν ιδανικά αέρια αλλά ναι αέριαπραγματικός. Αυτά τα αέρια έχουν σημαντικές αλληλεπιδράσεις μεταξύ των σωματιδίων τους, κάτι που μπορεί συνοψίζω, προκαλώντας τους ρευστοποιώ, αν υπάρχει πτώση θερμοκρασίας.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Χαρακτηριστικά των ιδανικών αερίων
Ρίξτε μια ματιά στο αφηρημένη, ορισμένα χαρακτηριστικά των ιδανικών αερίων:
- Σε αυτά συμβαίνουν μόνο τέλεια ελαστικές συγκρούσεις μεταξύ σωματιδίων.
- Σε αυτά δεν υπάρχουν αλληλεπιδράσεις μεταξύ σωματιδίων.
- Σε αυτά τα σωματίδια έχουν αμελητέες διαστάσεις.
- 1 mole ιδανικού αερίου καταλαμβάνει όγκο 22,4 l, ανεξάρτητα από το τι είναι το αέριο.
- Τα πραγματικά αέρια συμπεριφέρονται σαν ιδανικά αέρια όταν βρίσκονται υπό συνθήκες χαμηλής πίεσης και υψηλής θερμοκρασίας.
- Τα περισσότερα αέρια συμπεριφέρονται παρόμοια με τα ιδανικά αέρια.
ιδανικός νόμος για το φυσικό αέριο
Η μελέτη των αερίων που αναπτύχθηκε από τους μελετητές ΚάρολοςαγόριΙωσήφΛούιςgay-lussac και Ροβέρτοςαγόρι οδήγησε στην εμφάνιση του τρεις εμπειρικοί νόμοι, χρησιμοποιείται για να εξηγήσει τη συμπεριφορά των ιδανικών αερίων σε καθεστώτα του θερμοκρασία, πίεση και Ενταση ΗΧΟΥσταθερές, αντίστοιχα.
Μαζί αυτοί οι νόμοι αποτέλεσαν την απαραίτητη βάση για την εμφάνιση του ιδανικός νόμος για το φυσικό αέριο, που σχετίζεται με το αρχική θερμοδυναμική κατάσταση ενός αερίου, καθορίζεται από τις ποσότητες P1, Τ1 και V1, Με το δικό σου τελική θερμοδυναμική κατάσταση (Π2, V2 και Τ2), αφού υπέφεραν κάποια μετασχηματισμός αερίου.
Δείτε το τύπος του γενικού νόμου περί φυσικού αερίου:

Ο γενικός νόμος για το φυσικό αέριο αναφέρει ότι το προϊόν δίνει πίεση γούνα Ενταση ΗΧΟΥτουαέριο, διαιρούμενη με τη θερμοδυναμική θερμοκρασία, σε kelvin, είναι ίση με μια σταθερά. Αυτή η σταθερά, με τη σειρά της, περιγράφεται από το εξίσωση clapeyron, παρακολουθώ:

όχι - αριθμός γραμμομορίων (mol)
Ρ - καθολική σταθερά τέλειων αερίων (0,082 atm.l / mol. Κ ή 8,31 J / mol. Κ)
Στον τύπο, Π είναι η πίεση που ασκείται από το αέριο, Β είναι ο όγκος που καταλαμβάνεται από αυτό το αέριο, και Τ είναι η θερμοκρασία, μετρούμενη σε kelvin. το μεγαλείο όχι αναφέρεται στον αριθμό γραμμομορίων, ενώ Ρ είναι η καθολική σταθερά ιδανικών αερίων, η οποία μετράται συχνά σε μονάδες atm.l / mol. Κ ή σε J / mol. Κ, το τελευταίο υιοθετείται από το ΣΙ.
Κοίταεπίσης:Τι είναι ο ηλιακός άνεμος και πώς επηρεάζει την ατμόσφαιρα της Γης;
Εσωτερική ενέργεια ιδανικού αερίου
Ο ενέργειαεσωτερικός ιδανικών αερίων μπορεί να υπολογιστεί χρησιμοποιώντας το προϊόν μεταξύ του συνεχήςσεΜπόλτζμαν και τη θερμοδυναμική θερμοκρασία, σημειώστε:

κσι - Σταθερά Boltzmann (κσι = 1,38.10-23 Κ / Κ)
Από την προηγούμενη σχέση, η οποία μας επιτρέπει να υπολογίσουμε το μέση κινητική ενέργεια από τα σωματίδια ενός ιδανικού αερίου, σχεδιάζουμε τον ακόλουθο τύπο, ο οποίος μπορεί να χρησιμοποιηθεί για τον υπολογισμό του τι μέση τετραγωνική ταχύτητα μορίων ενός ιδανικού αερίου, για μια δεδομένη θερμοκρασία T, σημειώστε:

Μ - μοριακή μάζα (g / mol)
Αυτός ο τύπος σας επιτρέπει να δείτε ότι α πρόσθεσηστοθερμοκρασία ενός ιδανικού αερίου οδηγεί σε αύξηση της μέσης τετραγωνικής ταχύτητας των σωματιδίων.
Μάθετε περισσότερα:Μάθετε από ποιο φως είναι φτιαγμένο και ποια είναι τα χαρακτηριστικά του
Επιλυμένες ασκήσεις σε ιδανικά αέρια
Ερώτηση 1) Δύο γραμμομόρια ιδανικού αερίου, και σε πίεση 1 atm, βρίσκονται σε θερμοκρασία 227 ° C. Υπολογίστε, σε λίτρα, τον όγκο που καταλαμβάνει αυτό το αέριο.
Δεδομένα: R = 0,082 atm.l / mol. κ
α) 75 λίτρα
β) 82 λίτρα
γ) 15 λίτρα
δ) 27 λίτρα
ε) 25 λίτρα
Πρότυπο: Γράμμα Β
Ανάλυση:
Για να υπολογίσουμε τον όγκο αυτού του αερίου, θα χρησιμοποιήσουμε την εξίσωση Clapeyron, ωστόσο, προτού κάνουμε τον υπολογισμό, είναι απαραίτητο να μετατρέψουμε τη θερμοκρασία των 227 ° C σε kelvin. Γι 'αυτό προσθέτουμε τον παράγοντα 273 σε αυτήν τη θερμοκρασία, με αποτέλεσμα θερμοκρασία 500 Κ.

Σύμφωνα με το ψήφισμα, ο όγκος που καταλαμβάνεται από το αέριο είναι 82 λίτρα.
Ερώτηση 2) Ένα ιδανικό αέριο καταλαμβάνει όγκο 20 l, όταν υποβάλλεται σε πίεση 3 atm, έτσι ώστε η θερμοκρασία του να παραμένει σταθερή, ενώ ο όγκος του τριπλασιάζεται. Υπολογίστε την τελική πίεση αυτού του αερίου αφού περάσει από αυτόν τον μετασχηματισμό.
α) 1 atm
β) 3 atm
γ) 5 atm
δ) 8 atm
ε) 9 atm
Πρότυπο: Γράμμα Α
Ανάλυση:
Για να λύσουμε αυτήν την άσκηση, θα χρησιμοποιήσουμε τον γενικό νόμο των αερίων, σημειώστε:

Για να γίνει ο υπολογισμός, ήταν απαραίτητο να αντιστοιχιστεί ένας όγκος 60 l στο αέριο, καθώς ο όγκος του τριπλασιάστηκε κατά τη διάρκεια του μετασχηματισμού.
Από τον Rafael Hellerbrock
Καθηγητής φυσικής