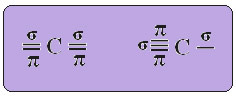
Ο υβριδισμός άνθρακα τύπου sp συμβαίνει μόνο όταν δημιουργεί δύο δεσμούς pi (π) και δύο δεσμούς σίγμα (σ). Σε αυτήν την περίπτωση, λοιπόν, υπάρχουν δύο δυνατότητες: ο άνθρακας μπορεί να δημιουργήσει δύο διπλούς δεσμούς ή έναν και έναν τριπλό δεσμό, όπως φαίνεται παρακάτω:
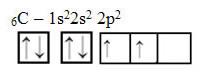
Το κείμενο "υβριδοποίηση τύπου sp3"Δείχνει λεπτομερώς πώς πραγματοποιείται η υβριδοποίηση άνθρακα. Να θυμόμαστε: ο υβριδισμός είναι η «ανάμιξη» καθαρών ατομικών τροχιακών, που προέρχονται από υβριδικά ατομικά τροχιακά ισοδύναμα μεταξύ τους, αλλά διαφορετικά από τα αρχικά καθαρά τροχιακά. Αυτό συμβαίνει στα τροχιακά άνθρακα που αρχικά εκπροσωπήθηκαν ως εξής:
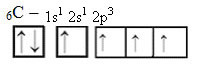
Ωστόσο, με την παραλαβή ενέργειας, ένα ηλεκτρόνιο (που αντιπροσωπεύεται από ένα βέλος) από την τροχιακή 2s προωθείται στην τροχιακή 2p:
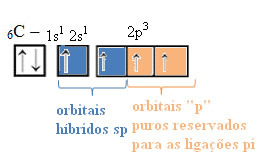
Με αυτόν τον τρόπο, ο άνθρακας έχει τέσσερα μη ζευγαρωμένα τροχιακά, που μπορεί να δημιουργήσει τέσσερις ομοιοπολικούς δεσμούς, όχι μόνο δύο.
Στην περίπτωση του υβριδισμού τύπου sp, γνωρίζουμε ότι δύο δεσμοί θα είναι pi; Αυτά συμβαίνουν στα καθαρά τροχιακά "p", ενώ τα άλλα δύο τροχιακά, τα οποία είναι sp υβρίδια, θα κάνουν τους υπόλοιπους δεσμούς σίγμα.
Η χωρική αναπαράσταση αυτής της υβριδοποίησης μεταξύ ενός s και p τροχιακού, που δημιουργεί ένα υβριδικό sp τροχιακό, μπορεί να αναπαρασταθεί ως εξής:
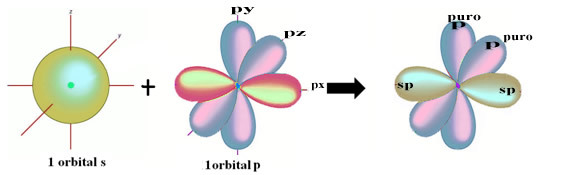
Στο παραπάνω σχήμα είναι πολύ σαφές ότι υπάρχουν δύο καθαρά τροχιακά που θα κάνουν τους δεσμούς pi.
Για να καταλάβετε πώς συμβαίνει αυτό, ας πάρουμε για παράδειγμα ένα μόριο κυανιούχου αερίου (HCN), το οποίο χρησιμοποιείται στις Ηνωμένες Πολιτείες σε θαλάμους αερίων για κρατούμενους που καταδικάζονται σε θανατική ποινή. Ο δομικός τύπος του δίνεται από:
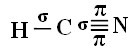
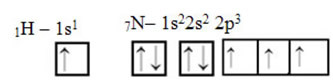
Όσον αφορά τον άνθρακα, έχουν ήδη αποδειχθεί οι ατομικές τροχιές του, τώρα κοιτάξτε τις τροχιές υδρογόνου και αζώτου:
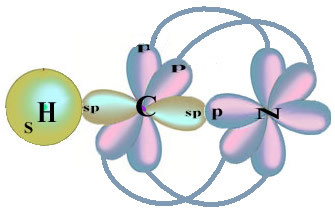
Σημειώστε ότι το ζεύγος τροχιακού υδρογόνου που θα εκτελέσει το δεσμό σίγμα είναι το «s», το οποίο αντιπροσωπεύεται χωρικά από έναν κύκλο. και τα τροχιακά αζώτου είναι τύπου «p», που αντιπροσωπεύονται από τρία διπλά ωοειδή (το καθένα σε χωρικό πεδίο: x, y, z). Έτσι, η δομή του μορίου HCN αντιπροσωπεύεται ως εξής:
Όσον αφορά τον τύπο ομολόγων που υπάρχουν σε αυτήν τη δομή φορμαλδεΰδης, έχουμε:
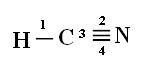
Συνδέσεις: 1 = σs-sp
2 = σp-sp
3 = 4 = ππ-π
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm
