Στο αντιδράσεις προσθήκηςσε αλκένια(υδρογονάνθρακες που έχουν διπλό δεσμό μεταξύ δύο ατόμων άνθρακα), ένας δεσμός pi μεταξύ δύο άνθρακα είναι σπασμένος και καθένας από τους άνθρακες συνδέεται με ένα νέο άτομο. Κοίτα:
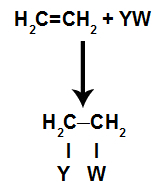
Γενικό σχηματικό μοντέλο αντίδρασης προσθήκης
Αρχές αντίδρασης προσθήκης
α) Σπάσιμο του συνδέσμου pi
Ένας δεσμός pi σπάει εύκολα επειδή είναι ένας ασθενέστερος δεσμός από έναν δεσμό σίγμα. Ωστόσο, για να συμβεί αυτό, είναι απαραίτητο το αλκένιο να υπόκειται σε συνθήκες που παρέχουν αυτή τη διακοπή. Μετά το σπάσιμο του δεσμού pi μεταξύ δύο άνθρακα, ένας τόπος σύνδεσης (για νέα άτομα) εμφανίζεται πάντα σε καθέναν από τους εμπλεκόμενους άνθρακες.
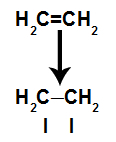
Σχηματική απεικόνιση θραύσης συνδέσμου pi
β) Προϋποθέσεις για τη διάσπαση ενός δεσμού pi
Οι παράγοντες που ευνοούν τη διάσπαση ενός δεσμού pi είναι:
Χρήση καταλυτών ·
Θέρμανση;
Παρουσία ενός οξέος στο μέσο αντίδρασης.
γ) Η εμφάνιση της αντίδρασης προσθήκης
Οι θέσεις δέσμευσης που δημιουργούνται μετά τη διάσπαση του δεσμού pi θα καταλαμβάνονται πάντα από άτομα του αντιδραστηρίου που βρίσκονται στον ίδιο περιέκτη με το αλκένιο. Η αντίδραση προσθήκης ονομάζεται από τον τύπο του αντιδραστηρίου που αναμιγνύεται με το αλκένιο.
Τύποι αντιδράσεων προσθήκης σε Αλκένια
α) Υδρογόνωση
Ένα αλκένιο αναμιγνύεται με αέριο υδρογόνο (Η2) σε ένα δοχείο και υποβάλλεται σε δράση ενός στερεού καταλύτη (νικέλιο, λευκόχρυσο ή παλλάδιο) και θέρμανση (Δ).
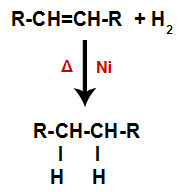
Γενικό σχήμα αντίδρασης υδρογόνωσης σε αλκένια
Η παρουσία του καταλύτη και η θέρμανση προκαλούν τον δεσμό pi του αλκενίου και τον δεσμό σίγμα μεταξύ των υδρογόνων του Η2 να σπάσει πιο γρήγορα. Με αυτό, έχουμε τη δημιουργία δύο θέσεων σύνδεσης στο αλκένιο και δύο ελεύθερων ατόμων υδρογόνου στο μέσο αντίδρασης.

Δημιουργία θέσεων σύνδεσης και διαχωρισμού ατόμων
Έτσι, αμέσως μετά, κάθε ελεύθερο άτομο υδρογόνου καταλαμβάνει μία από τις θέσεις σύνδεσης που σχηματίζονται στο αλκένιο. Δεδομένου ότι η ουσία που σχηματίζεται έχει μόνο άνθρακες και υδρογόνα, καθώς και μόνο απλούς δεσμούς μεταξύ των άνθρακα, είναι αλκανίου.
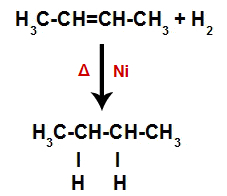
Εξίσωση που αντιπροσωπεύει το σχηματισμό αλκανίου στην υδρογόνωση
ΣΙ) Αλογόνωση
Ένα αλκένιο αναμιγνύεται με απλές ουσίες (F2, Cl2, αδερφέ2 Γεια2) σχηματισμένο από αλογόνα (χλώριο, φθόριο, ιώδιο και βρώμιο) σε ένα δοχείο και υπόκειται στη δράση του φωτός (λ) και της θέρμανσης (Δ).

Γενικό σχήμα αντίδρασης αλογόνωσης σε αλκένια
Η δράση του φωτός και της θέρμανσης καθιστά τον δεσμό pi του αλκενίου και τον δεσμό σίγμα μεταξύ των ουσιών που σχηματίζονται από το αλογόνο ώστε να σπάει πιο γρήγορα. Με αυτό, έχουμε τη δημιουργία δύο θέσεων σύνδεσης στο αλκένιο και δύο ελεύθερων ατόμων αλογόνου στο μέσο αντίδρασης.

Δημιουργία θέσεων σύνδεσης και διαχωρισμού ατόμων
Έτσι, αμέσως μετά, κάθε ελεύθερο άτομο αλογόνου καταλαμβάνει μία από τις θέσεις σύνδεσης που σχηματίζονται στο αλκένιο. Δεδομένου ότι η ουσία που σχηματίζεται έχει αλογόνο συνδεδεμένο με μια δομή που αποτελείται από άνθρακες και υδρογόνα, είναι μια οργανικό αλογονίδιο.

Εξίσωση που αντιπροσωπεύει οργανικό σχηματισμό αλογονιδίου σε αλογόνωση
γ) Ενυδάτωση
Ένα αλκένιο αναμιγνύεται με νερό (Η2Ο) σε δοχείο και υποβάλλεται σε δράση καταλύτη (στην περίπτωση αυτή, θειικό οξύ).
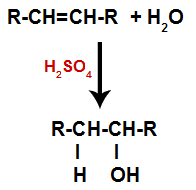
Γενικό σχήμα αντίδρασης ενυδάτωσης σε αλκένια
Η παρουσία θειικού οξέος στην αντίδραση καθιστά τον δεσμό pi του αλκενίου και τον δεσμό σίγμα μεταξύ υδρογόνου (Η) και υδροξυλίου (ΟΗ) νερού για να σπάσει πιο γρήγορα. Με αυτό, έχουμε τη δημιουργία δύο θέσεων σύνδεσης στο αλκένιο και ένα ελεύθερο υδρογόνο και ένα υδροξύλιο στο μέσο αντίδρασης.
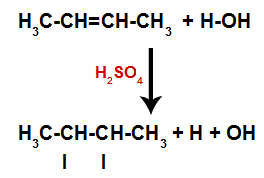
Δημιουργία θέσεων σύνδεσης και διαχωρισμού ατόμων
Έτσι, λίγο μετά, υδρογόνο και υδροξύλιο καταλαμβάνουν μία από τις θέσεις σύνδεσης που σχηματίζονται στο αλκένιο. Δεδομένου ότι η ουσία που σχηματίζεται έχει δεσμό υδροξυλίου με έναν κορεσμένο άνθρακα (δημιουργεί μόνο απλούς δεσμούς), είναι μια αλκοόλη.
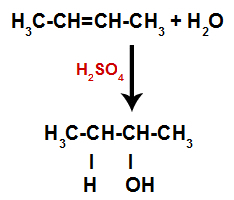
Εξίσωση που αντιπροσωπεύει το σχηματισμό αλκοόλ στην ενυδάτωση
δ) Προσθήκη με αλογονίδια υδρογόνου
Ένα αλκένιο αναμιγνύεται με αλογονωμένο ανόργανο οξύ (HF, HI, HCl, HBr) σε ένα δοχείο.

Γενικό σχήμα αντίδρασης αλογονιδίου οξέος σε αλκένια
Η παρουσία οξέος στην αντίδραση αναγκάζει τον δεσμό pi του αλκενίου να σπάσει πιο γρήγορα. Ο απλός δεσμός στο οξύ σπάει επειδή αυτές οι ουσίες ιοντίζονται φυσικά. Έτσι, δύο θέσεις σύνδεσης δημιουργούνται στο αλκένιο και υπάρχει η παρουσία ελεύθερου υδρογόνου και αλογόνου στο μέσο αντίδρασης.
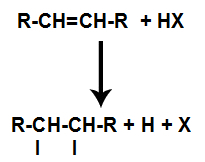
Δημιουργία θέσεων σύνδεσης και διαχωρισμού ατόμων
Έτσι, λίγο μετά, υδρογόνο και αλογόνο καταλαμβάνουν μία από τις θέσεις σύνδεσης που σχηματίζονται στο αλκένιο. Καθώς η ουσία που σχηματίζεται έχει αλογόνο συνδεδεμένο με μια δομή που αποτελείται από άνθρακες και υδρογόνα, είναι ένα οργανικό αλογονίδιο.
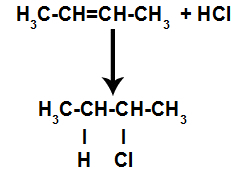
Εξίσωση που αντιπροσωπεύει οργανικό σχηματισμό αλογονιδίου σε αλογόνωση
Από μένα. Diogo Lopes Dias
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm
