Σε έναν ισοθερμικό μετασχηματισμό, το διακύμανση όγκου και πίεσης ενός συγκεκριμένου αερίου, αλλά το σταθερή θερμοκρασία; εξ ου και η προέλευση του ισοθερμικού ονόματος (Ελληνικά: ισο = ίσο; θερμο = θερμότητα).
Οι επιστήμονες Boyle και Mariotte, μεμονωμένα, πραγματοποίησαν παρόμοια πειράματα και το αποτέλεσμα που προέκυψε ήταν: καθώς η πίεση αυξάνεται, ο όγκος του αερίου μειώνεται.
Σκεφτείτε, για παράδειγμα, το έμβολο μιας σύριγγας. Εάν ασκήσουμε εξωτερική πίεση σε αυτό το έμβολο, δηλαδή εάν αυξήσουμε την πίεση, ο όγκος του αέρα που καταλαμβάνεται μέσα στη σύριγγα θα μειωθεί και το αντίστροφο.
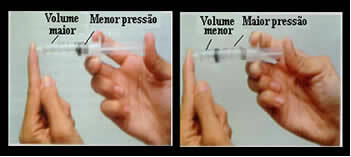
Ο όγκος και η πίεση είναι αντιστρόφως ανάλογες: στο αριστερό πλαίσιο, η πίεση είναι μικρή και ο όγκος που καταλαμβάνεται από τον αέρα είναι μεγάλος. Στα δεξιά, όταν ασκείται μεγαλύτερη πίεση στο έμβολο της σύριγγας, ο όγκος μειώνεται.
Δεν πρόκειται για μεμονωμένη περίπτωση, είναι κάτι που επαναλαμβάνεται με κοινή κανονικότητα για τα αέρια. Επομένως, το γεγονός αυτό δηλώθηκε με τη μορφή νόμου, ο οποίος μπορεί να περιγραφεί ως εξής:
| Ο νόμος του Boyle ή Ο νόμος του Boyle-Mariotte: Σε σταθερή θερμοκρασία, ο όγκος που καταλαμβάνεται από μια σταθερή μάζα αερίου είναι αντιστρόφως ανάλογος με την πίεση του. |
Αυτό σημαίνει ότι εάν διπλασιάσουμε την πίεση ενός αερίου, ο όγκος του θα μειωθεί στο μισό και ούτω καθεξής. Όταν δύο τέτοιες ποσότητες είναι αντιστρόφως ανάλογες, το προϊόν τους είναι σταθερή. Έτσι, μαθηματικά, αυτή η σχέση μπορεί να αναπαρασταθεί ως εξής:
| P.V = k |
Όπου k = σταθερά.
Έτσι, εάν σε μια πρώτη κατάσταση έχουμε την τιμή πίεσης ενός συγκεκριμένου αερίου ως P1 και τον αντίστοιχο όγκο του ως V1, τότε πρέπει:
| Π1. Β1 = κ |
Εάν αυξήσουμε αυτήν την πίεση σε P2, ο όγκος της θα αλλάξει επίσης σε V2 και πάλι θα πρέπει:
| Π2 . Β2 = κ |
Καταλήγουμε λοιπόν στο συμπέρασμα:
| Π1. Β1 = Ρ2. Β2 |
Αυτή η σταθερότητα φαίνεται από το παράδειγμα που δίνεται στον παρακάτω πίνακα, των πιέσεων και των όγκων ενός αερίου με σταθερή μάζα:
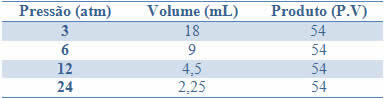
Γράφοντας αυτές τις τιμές, θα δούμε το σχηματισμό μιας καμπύλης.
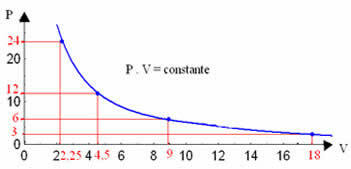
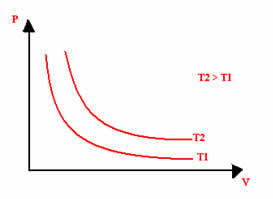
Η γραφική αναπαράσταση ενός ισοθερμικού μετασχηματισμού θα είναι πάντα μια υπερβολή, ανεξάρτητα από τις τιμές της πίεσης και του όγκου και της θερμοκρασίας στην οποία πραγματοποιήθηκε το πείραμα. Αυτή η υπερβολή ονομάζεται ισόθερμος γραμμή; έτσι, όπως φαίνεται στο παρακάτω γράφημα, διαφορετικές θερμοκρασίες δημιουργούν διαφορετικά ισοθερμικά.
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm

