Ο Χημική Κινητική είναι ένα πεδίο που μελετά τους παράγοντες που επηρεάζουν το ρυθμό ανάπτυξης χημικών αντιδράσεων, δηλαδή την ταχύτητα με την οποία λαμβάνουν χώρα. Υπάρχει όλο και περισσότερη έρευνα σε αυτόν τον τομέα, καθώς συχνά θέλουμε να επιταχύνουμε κάποιες αντιδράσεις ή να επιβραδύνουμε άλλες. Αυτό είναι ιδιαίτερα σημαντικό για τις βιομηχανίες και αυτή η έρευνα έχει σημαντικές τεχνολογικές συνέπειες.
Αλλά επειδή η ταχύτητα μιας αντίδρασης μπορεί να ποικίλει σε κάθε χρονικό διάστημα και από τη μία ουσία στην άλλη, είναι σύνηθες να υπολογίζεται το μέση ταχύτητα αντίδρασης.
Εξετάστε την ακόλουθη γενική αντίδραση, όπου οι συντελεστές είναι πεζά γράμματα και τα αντιδραστήρια και τα προϊόντα αντιπροσωπεύονται με κεφαλαία γράμματα:
a A + b B → c C + d D
Θα δοθεί η μέση ταχύτητα αυτής της αντίδρασης διαιρώντας τον μέσο ρυθμό αντίδρασης οποιασδήποτε από τις αντιδρώντες ουσίες ή τον μέσο ρυθμό σχηματισμού οποιουδήποτε από τα προϊόντα με τον αντίστοιχο συντελεστή του στη χημική εξίσωση. Αυτό δίνεται από:
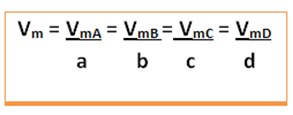
Για παράδειγμα, εξετάστε την αντίδραση αποσύνθεσης υπεροξειδίου του υδρογόνου:
2 ώρες2Ο2 (υδ) → 2 Ω2Ο(1) + 1 Ο2 (ζ)
Ας πούμε ότι σε 1 λεπτό σχηματίστηκαν 0,3 mol / L Η2Ο και 0,15 mol / L Ο2, ενώ 0,3 mol / L του H αποσυντέθηκαν2Ο2, δηλαδή, οι μέσοι ρυθμοί αποσύνθεσης και σχηματισμού αυτών των ουσιών στην αντίδραση είναι:
ΒmH2O2 = 0,3 mol / L. ελάχ
ΒmH2O = 0,3 mol / L. ελάχ
ΒmO2 = 0,15 mol / L. ελάχ
Η μέση ταχύτητα της παγκόσμιας αντίδρασης θα βρεθεί λαμβάνοντας μία από αυτές τις τιμές και διαιρώντας την με τον αντίστοιχο συντελεστή στην εξίσωση:
ΒΜ = ΒmH2O2 = 0,3 mol / L. ελάχ = 0,15 mol / L. ελάχ
2 2
ΒΜ = ΒmH2O = 0,3 mol / L. ελάχ = 0,15 mol / L. ελάχ
2 2
ΒΜ = ΒmO2 = 0,15 mol / L. ελάχ = 0,15 mol / L. ελάχ
1 1
Σημειώστε ότι οι τρεις τιμές είναι ίσες, επομένως, ο ρυθμός αντίδρασης είναι ο ίδιος με τη συνάρτηση οποιουδήποτε αντιδραστηρίου ή προϊόντος, στο ίδιο χρονικό διάστημα.
Ωστόσο, πώς βρέθηκαν οι τιμές των μέσων ταχυτήτων καθεμιάς από τις ουσίες που εμπλέκονται σε αυτές τις αντιδράσεις;
Μπορεί να υπολογιστεί διαιρώντας τη διακύμανση της συγκέντρωσης της ουσίας (αντιδραστήριο ή προϊόν) με το χρονικό διάστημα. Εάν πρόκειται να προσδιορίσουμε τη μέση ταχύτητα ενός από τα αντιδραστήρια της αντίδρασης, θα πρέπει να βάλουμε ένα αρνητικό σημάδι πριν, αλλιώς λάβετε υπόψη την τιμή συγκέντρωσης στην ενότητα ||, αφού, δεδομένου ότι η συγκέντρωση του αντιδρώντος μειώνεται με την πάροδο του χρόνου, η τιμή ταχύτητας θα είναι αρνητική, αλλά δεν υπάρχει αρνητική ταχύτητα.

Για παράδειγμα, εξετάστε την ακόλουθη αντίδραση αποσύνθεσης αερίου όζοντος (O3 (ζ)) σε αέριο οξυγόνο (O2 (ζ)):
2 Ο3 (ζ) → 3 O2 (ζ)
Ας πούμε ότι σε ένα μπαλόνι υπήρχαν 10 γραμμομόρια αερίου όζοντος, αλλά μετά από 1 λεπτό, έμειναν μόνο 4 γραμμομόρια. Αυτό σημαίνει ότι 6 γραμμομόρια όζον μετατράπηκαν σε αέριο οξυγόνο. Έτσι έχουμε:
2 Ο3 (ζ) → 3 O2 (ζ)
t = 0 min 2 mol / L 0 mol / L
σχηματισμένα έξοδα
6 mol / L 9 mol / L
t = 1 λεπτό 4 mol / L 9 mol / L
Σημειώστε ότι επειδή ο λόγος αντίδρασης είναι 2: 3, τότε εάν χρησιμοποιήθηκαν 6 mol του Ο3Σχηματίστηκαν 9 mol Ο2. Έτσι, μετά από 1 λεπτό, έχουμε τις ακόλουθες μέσες ταχύτητες:
ΒΜ = - Δ [Το3]
τ
ΒΜ = - ([Ο3 τελικό - Ο3 αρχικό])
τΤελικός - ταρχικός
ΒΜ = - ([4 - 10])
1– 0
ΒΜ = 6 mol / L. ελάχ→ Για 1 λεπτό, 6 mol όζοντος αντέδρασαν σε κάθε λίτρο του συστήματος.
ΒΜ = Δ [Το2]
τ
ΒΜ = ([Ο2η τελική - Ο2 αρχικό])
τΤελικός - ταρχικός
ΒΜ = ([9 - 0])
1– 0
ΒΜ = 9 mol / L. ελάχ→ Κατά τη διάρκεια 1 λεπτού, 9 γραμμομόρια οξυγόνου σχηματίστηκαν σε κάθε λίτρο του συστήματος.
Αυτό μας δείχνει ότι μπορούμε να υπολογίσουμε τη μέση ταχύτητα ως συνάρτηση των αντιδρώντων ή ως συνάρτηση των προϊόντων.
Τώρα, αν θέλουμε να υπολογίσουμε τη μέση ταχύτητα αυτής της παγκόσμιας αντίδρασης, κάντε ακριβώς όπως δείξαμε στην αρχή: διαιρέστε κάθε μία από αυτές τις ταχύτητες με τους αντίστοιχους συντελεστές τους στη χημική εξίσωση:
ΒΜ = ΒmO3 = 6 mol / λίτρο. ελάχ = 3 mol / L. ελάχ
2 21
ΒΜ = ΒmO2 = 9 mol / λίτρο. ελάχ = 3 mol / L. ελάχ
3 3
ΒΜ = ΒmO3 = ΒmO2
23
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm


