ΕΝΑ ηλεκτροσφαίρα είναι η περιοχή του ατόμου στην οποία τα ηλεκτρόνια Βρίσκονται. Η ηλεκτρόσφαιρα, πιο συγκεκριμένα, αποτελείται από ατομικά τροχιακά, που προσδιορίζονται με την επίλυση της εξίσωσης Schrödinger. Καθορίστηκε για πρώτη φορά από το μοντέλο του Rutherford, η ηλεκτρόσφαιρα έλαβε σημαντικές προόδους κατά τη διάρκεια της ισχύος του ατομικού μοντέλου του Bohr.
Η ηλεκτρόσφαιρα μπορεί να χωριστεί σε στρώματα (ή ενεργειακά επίπεδα), καθώς τα ηλεκτρόνια έχουν καθορισμένη (μη συνεχή) ενέργεια. Για άτομα με δύο ή περισσότερα ηλεκτρόνια, τα κελύφη χωρίζονται σε υποφλοιούς (ή υποφλοιούς). Η ηλεκτρόσφαιρα είναι εξαιρετικά σημαντική για την κατανόηση των ιδιοτήτων του ατόμου και την κατανόηση του σχηματισμού χημικών δεσμών.
Διαβάστε επίσης: Πώς χωρίζεται το άτομο;
Περίληψη για την ηλεκτρόσφαιρα
Η ηλεκτρόσφαιρα είναι η περιοχή του ατόμου στην οποία βρίσκονται τα ηλεκτρόνια.
Αποτελείται από ατομικά τροχιακά, κυματοσυναρτήσεις που είναι λύσεις στις εξισώσεις του Schrödinger.
Η ιδέα του ξεκίνησε με το μοντέλο του Ernest Rutherford.
Τα ηλεκτρόνια συγκρατούνται στην ηλεκτρόσφαιρα λόγω της έλξης τους προς τον ατομικό πυρήνα.
Η κύρια πρόοδος στην κατανόηση της ηλεκτροσφαίρας συνέβη κατά τη σύλληψη του μοντέλου του Niels Bohr.
Αποτελείται από στρώματα (ή ενεργειακά επίπεδα), τα οποία είναι περιοχές καθορισμένης ενέργειας.
Για άτομα με περισσότερα από ένα ηλεκτρόνια, τα κελύφη χωρίζονται σε υποφλοιούς (ή υποφλοιούς).
Η ηλεκτρόσφαιρα είναι σημαντική για την κατανόηση πολλών ιδιοτήτων, όπως η ατομική ομοιότητα, η σταθερότητα, ατομική ακτίνα, ενέργεια ιονισμού, συγγένεια ηλεκτρονίων, εκτός από την κατανόηση του σχηματισμού δεσμών χημικά.
Βίντεο μάθημα για την ηλεκτρόσφαιρα
Τι είναι η ηλεκτρόσφαιρα;
Η ηλεκτρόσφαιρα ορίζεται ως την περιοχή της ατομικής δομής στην οποία βρίσκονται τα ηλεκτρόνια. Σε πιο εμπεριστατωμένες ερμηνείες, λέμε ότι αποτελείται από ατομικά τροχιακά, κυματοσυναρτήσεις που είναι λύσεις στην εξίσωση του Σρέντιγκερ. Η μαθηματική έκφραση ενός ατομικού τροχιακού, όταν τετραγωνιστεί, παρουσιάζει την πυκνότητα πιθανότητας της θέσης του ηλεκτρονίου σε ένα δεδομένο σημείο.
Ο η έννοια της ηλεκτροσφαίρας άρχισε να αναδύεται με το Το ατομικό μοντέλο του Ernest Rutherford, το οποίο διαθέτει ηλεκτρόνια που περιφέρονται γύρω από έναν πυκνό, θετικό πυρήνα. Αργότερα, ο Niels Bohr έφερε πιο σημαντικές ερμηνείες της ηλεκτροσφαίρας αναμειγνύοντας έννοιες από την κβαντική μηχανική.
Στρώματα της ηλεκτροσφαίρας
Τα ηλεκτρόνια συγκρατούνται στην ηλεκτρόσφαιρα λόγω της έλξης τους προς τον ατομικό πυρήνα. Ωστόσο είναι γνωστό ότι αυτά Τα ηλεκτρόνια βρίσκονται σε κελύφη των οποίων οι ενέργειες είναι καλά καθορισμένες. Τέτοια στρώματα μπορούν επίσης να ονομαστούν επίπεδα ενέργειας.
Αυτό το συμπέρασμα προέκυψε μετά από πειράματα φασματοσκοπίας. Για παράδειγμα, όταν εφαρμόζεται ηλεκτρικό ρεύμα στο αέριο H2 Σε χαμηλή πίεση, το φως εκπέμπεται από το H2. Σε αυτή την κατάσταση, σχηματίζονται ιόντα Η+ και ηλεκτρόνια, τα οποία θα επιστρέψουν στα ιόντα Η+ και θα σχηματίσει διεγερμένα (ενεργοποιημένα) είδη H+. Για την ανακούφιση της περίσσειας ενέργειας, ιόντα Η+ απελευθερώνουν ενέργεια με τη μορφή ηλεκτρομαγνητικής ακτινοβολίας (φως) και ανασυνδυάζονται σε αέριο Η2 πάλι.
Ίσως θυμάστε ότι όταν το λευκό φως διέρχεται από ένα πρίσμα, διασπάται σε ένα συνεχές φάσμα (παρόμοιο με το ουράνιο τόξο). Ωστόσο, δεν συμβαίνει το ίδιο με το φως που προέρχεται από το H2: όταν μια τέτοια ακτινοβολία διέρχεται από το πρίσμα, παρατηρούνται μόνο φωτεινές γραμμές με καθορισμένο μήκος κύματος στο φάσμα εκπομπής Η2, γνωστές ως φασματικές γραμμές.
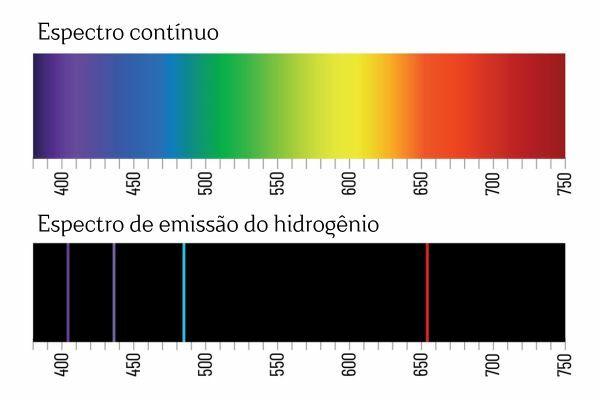
Η ερμηνεία για τα φάσματα εκπομπής των στοιχείων (με καλά καθορισμένες φασματικές γραμμές) είναι ότι ένα ηλεκτρόνιο, σε ένα άτομο, δεν μπορεί να παρουσιάσει καμία ενέργεια, αλλά μάλλον σε καλά καθορισμένες ποσότητες (τα λεγόμενα ενεργειακά πακέτα). Εάν τα ηλεκτρόνια δεν είχαν τέτοιους ενεργειακούς περιορισμούς, το φάσμα εκπομπής των στοιχείων θα ήταν συνεχές, ακριβώς όπως αυτό του λευκού φωτός που διέρχεται από ένα πρίσμα.
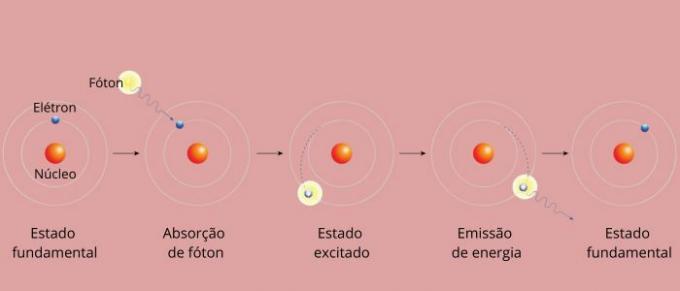
Κάθε φασματική γραμμή ενός στοιχείου έγινε γνωστή ως ενεργειακό επίπεδο. (ή στρώμα, όπως συνηθίζουμε να λέμε περισσότερο). Αυτές οι γραμμές προκύπτουν όταν ένα ηλεκτρόνιο περνά από το ένα επιτρεπόμενο επίπεδο ενέργειας στο άλλο, σε μια διαδικασία αλλαγής ενέργειας γνωστή ως ηλεκτρονική μετάβαση.
Κατά την ηλεκτρονική μετάβαση, το ηλεκτρόνιο περνά από ένα χαμηλότερο επίπεδο ενέργειας σε ένα υψηλότερο ενεργειακό επίπεδο. Όταν επιστρέφει στο αρχικό του επίπεδο, εκπέμπει περίσσεια ενέργειας μέσω της ηλεκτρομαγνητικής ακτινοβολίας (φως), δίνοντας αρχή στη φασματική γραμμή της οποίας η ενεργειακή τιμή που εκπέμπεται είναι ανάλογη με μια τιμή που ορίζεται από την εξίσωση του Rydberg.
Ο Johannes Rydberg ήταν ένας Σουηδός φασματογράφος που δημιούργησε μια εξίσωση για να καθορίσει την τάση των φασματικών γραμμών με βάση το έργο του Ελβετού καθηγητή Johann Balmer. Η ειδική ενέργεια κάθε στρώματος ορίζεται λύνοντας την κατάλληλη εξίσωση Schrödinger.
Κάθε ηλεκτρονικό στρώμα έχει έναν αριθμό ηλεκτρονίων που επιτρέπεται. Επί του παρόντος, ορίζονται επτά ηλεκτρονικά επίπεδα, που προσδιορίζονται από τα γράμματα K έως Q, με αλφαβητική σειρά ή από το γράμμα n, όπου n ≥ 1. Έτσι, το στρώμα Κ είναι το στρώμα όπου n = 1, και ούτω καθεξής. Ο αριθμός των επιτρεπόμενων ηλεκτρονίων ανά κέλυφος φαίνεται στον παρακάτω πίνακα.
Επίπεδο ενέργειας |
Στρώμα |
Μέγιστος αριθμός ηλεκτρονίων |
1 |
κ |
2 |
2 |
μεγάλο |
8 |
3 |
Μ |
18 |
4 |
Ν |
32 |
5 |
Ο |
32 |
6 |
Π |
18 |
7 |
Q |
8 |
Για υδρογονοειδή άτομα (με μόνο 1 ηλεκτρόνιο, όπως H, He+, Li2+), όλα τα ατομικά τροχιακά έχουν την ίδια ενέργεια (τα ονομάζουμε εκφυλισμένα τροχιακά). Ωστόσο, σε άτομα με δύο ή περισσότερα ηλεκτρόνια, προκύπτει ένα πολύ σημαντικό φαινόμενο, η απώθηση ηλεκτρονίου-ηλεκτρονίου. Συνέπεια αυτού του γεγονότος είναι ότι τα τροχιακά κάθε στρώματος αρχίζουν να έχουν διαφορετικές ενέργειες και, ως εκ τούτου, τα στρώματα αρχίζουν να περιγράφονται ως υποστιβάδες (ή υποεπίπεδα).
Για τα τρέχοντα άτομα, κάθε στρώμα μπορεί να αποσυντεθεί σε έως και τέσσερα υποεπίπεδα, που αντιπροσωπεύεται από τα γράμματα "s" (από τα αγγλικά, αιχμηρός), "p" (από τα αγγλικά, κύριος), "d" (από τα αγγλικά, διάχυτος) και "f" (από τα αγγλικά, θεμελιώδης).
Κάθε υποεπίπεδο υποστηρίζει έναν μέγιστο αριθμό ηλεκτρονίων, που ορίζεται από υπολογισμούς και πειράματα. Το υποεπίπεδο «s» υποστηρίζει έως και 2 ηλεκτρόνια. το υποεπίπεδο "p", έως 6 ηλεκτρόνια. το υποεπίπεδο «d», έως 10 ηλεκτρόνια. και το υποεπίπεδο «f», έως 14 ηλεκτρόνια. Το στρώμα Κ είναι το μόνο που επιτρέπει μόνο ένα μόνο τροχιακό και, επομένως, έχει μόνο ένα μόνο υποεπίπεδο.
Επίπεδο ενέργειας |
Στρώμα |
Υποεπίπεδα |
1 |
κ |
1s |
2 |
μεγάλο |
2s, 2p |
3 |
Μ |
3s, 3p, 3d |
4 |
Ν |
4s, 4p, 4d, 4f |
5 |
Ο |
5s, 5p, 5d, 5f |
6 |
Π |
6s, 6p, 6d |
7 |
Q |
7s, 7p |
Λειτουργία της ηλεκτροσφαίρας
Η ηλεκτρόσφαιρα κάθε ατόμου μπορεί να χρησιμοποιηθεί για να εξηγήσει διάφορες ιδιότητες και συμπεριφορές του ατόμου.
Ιδιότητες όπως η ατομική ακτίνα, η ιοντική ακτίνα, η ενέργεια ιονισμού και η συγγένεια ηλεκτρονίων έχουν τιμές που είναι άμεση συνέπεια της ηλεκτρονικής διαμόρφωσης της ηλεκτροσφαίρας, πιο συγκεκριμένα της που ονομάζεται κέλυφος σθένους, που είναι στην πραγματικότητα το πιο εξωτερικό κατειλημμένο ηλεκτρονικό κέλυφος ενός ατόμου ή ιόντος.
ΕΝΑ Η ομοιότητα μεταξύ ατόμων από την ίδια ομάδα στον Περιοδικό Πίνακα είναι επίσης συνέπεια της ηλεκτρονικής διαμόρφωσης του κελύφους σθένους. Στις χημικές διεργασίες, επιλέγουμε όσο το δυνατόν άτομα από την ίδια ομάδα στον Περιοδικό Πίνακα υποκαταστάτες, και αυτό είναι μόνο εύλογο, καθώς αυτά τα άτομα έχουν την ίδια ηλεκτρονική διαμόρφωση στο στρώμα του σθένους.
Στο χημικοί δεσμοί, που εμφανίζονται μεταξύ ατόμων για να σχηματίσουν ιοντικές και ομοιοπολικές ενώσεις (μόρια), συμβαίνουν επίσης μέσω αλληλεπιδράσεων μεταξύ των ηλεκτροσφαιρών των ατόμων.
Διαβάστε επίσης: Το ατομικό μοντέλο του Schrödinger — τρόπος περιγραφής του ατόμου χρησιμοποιώντας την κβαντική μηχανική
Σχέση ηλεκτροσφαίρας και ατομικής δομής
Όπως σημειώθηκε, η ηλεκτρόσφαιρα περιλαμβάνει την περιοχή του ατόμου στην οποία μπορούν να βρεθούν τα ηλεκτρόνια. Τα ηλεκτρόνια, πιο συγκεκριμένα, βρίσκονται σε ατομικά τροχιακά, τα οποία έχουν ενέργεια που ορίζεται από κβαντικούς υπολογισμούς.
Η ηλεκτρόσφαιρα είναι η μεγαλύτερη περιοχή της ατομικής δομής, αφού ο πυρήνας ενός ατόμου είναι πολύ μικρός. Θεωρώντας το άτομο ως γήπεδο ποδοσφαίρου, ο πυρήνας θα αντιστοιχούσε σε μια μπάλα στο κέντρο του γηπέδου, ενώ το υπόλοιπο στάδιο θα ήταν η ηλεκτρόσφαιρα.
Παρόλα αυτά, Όσον αφορά τη μάζα, η ηλεκτρόσφαιρα συνεισφέρει ελάχιστα. Καθώς η μάζα των ηλεκτρονίων είναι περίπου 1836 φορές μικρότερη από αυτή των πρωτονίων και των νετρονίων, μπορούμε να πούμε ότι σχεδόν όλη η μάζα του ατόμου είναι συγκεντρωμένη στον πυρήνα.
Λυμένες ασκήσεις στην ηλεκτρόσφαιρα
ερώτηση 1
(Facisb 2023) Στο μοντέλο του Bohr για το άτομο υδρογόνου, το ηλεκτρόνιο μπορεί να καταλάβει μόνο ορισμένες τροχιές. Μερικές από αυτές τις τροχιές αντιπροσωπεύονται στο σχήμα, όπου το n αναφέρεται στα ενεργειακά επίπεδα που έχει το ηλεκτρόνιο σε κάθε τροχιά.
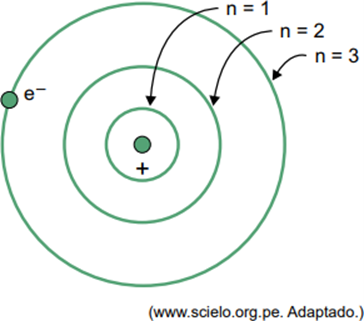
Σκεφτείτε ότι, σε ένα άτομο υδρογόνου, το ηλεκτρόνιο βρίσκεται στην τροχιά όπου n = 5.
Σύμφωνα με το μοντέλο του Bohr, αυτό το ηλεκτρόνιο θα εκπέμπει ενέργεια με τη μορφή ηλεκτρομαγνητικής ακτινοβολίας μόνο όταν
(Α) κάντε μια μετάβαση στην τροχιά στην οποία το n είναι ίσο με 6.
(Β) παραμένουν στην τροχιά όπου n = 5.
(Γ) μετάβαση σε οποιαδήποτε τροχιά στην οποία το n είναι μεγαλύτερο από 5.
(Δ) μετάβαση σε οποιαδήποτε τροχιά στην οποία το n είναι μικρότερο από 5.
Το (Ε) εκτοξεύεται από το άτομο, ιονίζοντάς το.
Απάντηση: Γράμμα Δ
Όταν ένα ηλεκτρόνιο βρίσκεται σε ένα εξωτερικό περίβλημα, κατά την επιστροφή του σε ένα εσωτερικό κέλυφος με χαμηλότερη ενέργεια, απελευθερώνει περίσσεια ενέργειας με τη μορφή ηλεκτρομαγνητικής ακτινοβολίας (φως). Επομένως, η εμφάνιση φωτός θα συμβεί μόνο όταν το ηλεκτρόνιο που υπάρχει σε n = 5 κάνει μια μετάβαση σε ένα εσωτερικό κέλυφος.
Ερώτηση 2
(Uerj 2019) Πρόσφατα, οι επιστήμονες κατάφεραν να παράγουν μεταλλικό υδρογόνο συμπιέζοντας μοριακό υδρογόνο υπό υψηλή πίεση. Οι μεταλλικές ιδιότητες αυτού του στοιχείου είναι οι ίδιες με τα άλλα στοιχεία της ομάδας 1 του περιοδικού πίνακα ταξινόμησης.
Αυτή η ομοιότητα σχετίζεται με το πιο ενεργειακό υποεπίπεδο αυτών των στοιχείων, το οποίο αντιστοιχεί σε:
(A) ns1
(Β) ν.π.2
(Γ) να3
(Δ) nf4
Απάντηση: Γράμμα Α
Το άτομο υδρογόνου έχει μόνο ένα ηλεκτρόνιο, το οποίο βρίσκεται στο πρώτο επίπεδο, υποεπίπεδο «s» (1s1). Ένας λόγος για τον οποίο βρίσκεται στην ομάδα 1 του Περιοδικού Πίνακα είναι επειδή όλα τα άλλα χημικά στοιχεία αυτής της ομάδας έχουν άτομα των οποίων το κέλυφος σθένους είναι του ίδιου τύπου (ns1). Επομένως, λόγω ενός παρόμοιου στρώματος σθένους, το υδρογόνο μπόρεσε να παραχθεί σε αυτή τη μεταλλική μορφή.
Πηγές:
ΝΤΟ ΚΑΝΤΟ, Ε. ΜΕΓΑΛΟ.; ΛΕΙΤΕ, Λ. ΜΕΓΑΛΟ. W.; ΚΑΝΤΟ, Λ. W. Χημεία - στην καθημερινή ζωή. 1. εκδ. Σάο Πάολο: Moderna, 2021.
ATKINS, Ρ.; JONES, L.; ΛΑΒΕΡΜΑΝ, Λ. Αρχές Χημείας: Αμφισβήτηση της ζωής και του περιβάλλοντος. 7. εκδ. Porto Alegre: Bookman, 2018.
ATKINS, Ρ.; DE PAULA, J.; ΚΙΛΕΡ, Τζ. Η Φυσικοχημεία του Άτκινς. 11 ed. Οξφόρδη: Oxford University Press, 2018.

