Ο δομικός τύπος είναι ένας τρόπος αναπαράστασης των δεσμών μεταξύ των στοιχείων, με κάθε ζεύγος ηλεκτρονίων να μοιράζεται μεταξύ δύο ατόμων που συμβολίζονται με μια παύλα:
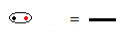
Κοινόχρηστο ζεύγος ηλεκτρονίων που συμβολίζεται με παύλα
Αυτό σημαίνει ότι όλοι οι τύποι ομοιοπολικών δεσμών εμφανίζονται στη δομική φόρμουλα, είτε μονή, διπλή ή τριπλή:
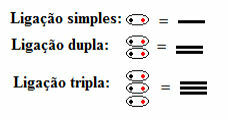
Ενιαίοι, διπλοί και τριπλοί δεσμοί συμβολίζονται με παύλες σε δομικούς τύπους
Κοιτάξτε μερικά παραδείγματα συντακτικών τύπων μικρών μορίων που περιλαμβάνουν λίγους δεσμούς και παρατηρήστε πώς αντιπροσωπεύονται τα κοινά ζεύγη ηλεκτρονίων.
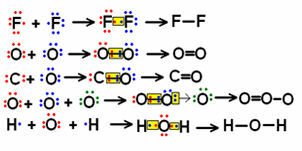
Παραδείγματα συντακτικών τύπων για ορισμένα μόρια
Οι τύποι που εμφανίζονται πάνω αριστερά, όπου τα ηλεκτρονικά ζεύγη συμβολίζονται με "κουκκίδες", καλούνται ηλεκτρονικοί τύποι ή Τύποι Lewis. Όλα αυτά τα μόρια είναι ανόργανες ουσίες, αλλά οι δομικοί τύποι χρησιμοποιούνται γενικά περισσότερο στην περίπτωση οργανικών ενώσεων, οι οποίες είναι εκείνα που σχηματίζονται από το στοιχείο άνθρακα, τα οποία δεν είναι ορυκτής προέλευσης (όπως στην περίπτωση του μονοξειδίου του άνθρακα (CO), το οποίο θεωρείται ανόργανος).
Δεδομένου ότι ο άνθρακας είναι τετρασθενής (δημιουργεί τέσσερις ομοιοπολικούς δεσμούς), έχει το μεγάλο ικανότητα πρόσδεσης σε διαφορετικά άτομα και άλλους άνθρακες, σχηματίζοντας ένα άπειρο αλυσίδων ανθρακικός. Γι 'αυτό η δομική φόρμουλα είναι σημαντική γιατίδείχνει τη διάταξη των ατόμων στην αλυσίδα.
Για να καταλάβετε, λάβετε υπόψη τα εξής: α μοριακός τύπος υποδεικνύει μόνο τον αριθμό κάθε στοιχείου σε ένα μόριο της ουσίας. Για παράδειγμα, ας πούμε ότι έχουμε τον μοριακό τύπο C3Η6, ξέρουμε τότε ότι έχει τρία άτομα άνθρακα και έξι άτομα υδρογόνου, αλλά πώς συνδέονται; Ο συντακτικός τύπος θα μας το πει αυτό και μπορούμε πραγματικά να μάθουμε ποια ένωση είναι. Σημειώστε παρακάτω ότι αυτός ο μοριακός τύπος μπορεί να δημιουργήσει δύο διαφορετικούς συντακτικούς τύπους και, κατά συνέπεια, σε δύο διαφορετικές ουσίες:

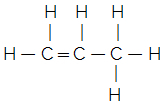
Προπένιο κυκλοπροπανίου
Αυτά μπορούν να κληθούνεπίπεδες δομικές φόρμουλες, στην οποία όλες οι συνδέσεις και όλα τα στοιχεία σχεδιάζονται στο επίπεδο του χαρτιού, στον πίνακα, στην οθόνη του υπολογιστή κ.λπ.
Ωστόσο, πολλές αλυσίδες άνθρακα είναι πολύ μεγάλες και αρκετά περίπλοκες, οπότε θα ήταν δύσκολο να γράφουμε κάθε φορά τη δομική φόρμουλα.
Έτσι, δημιουργήθηκαν άλλες μορφές αναπαράστασης της δομής των μορίων που είναι πιο απλοποιημένες. Το πρώτο είναι το απλοποιημένος ή συμπυκνωμένος συντακτικός τύπος, στην οποία η ποσότητα των ατόμων υδρογόνου που συνδέονται με κάθε άνθρακα συντομεύεται τοποθετώντας το σύμβολό του (H) μόλις μία φορά και προσθέτοντας στην κάτω δεξιά γωνία έναν δείκτη, που είναι ένας αριθμός που δείχνει πόσα υδρογόνα υπάρχει.
Για παράδειγμα, εξετάστε τον επίπεδο δομικό τύπο του κοινού αιθέρα:
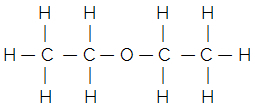
Ο απλοποιημένος ή συμπυκνωμένος δομικός τύπος δίνεται από:
Η3Γ - ΧΗ2 - Ο - CH2 - CH3
Πολύ απλούστερο, έτσι δεν είναι ;!
Αλλά γνωρίζοντας ότι ο άνθρακας δημιουργεί πάντα τέσσερις δεσμούς και ότι το υδρογόνο δημιουργεί μόνο έναν δεσμό, ένας άλλος απλούστερος τύπος προέκυψε, που είναι ο τύπος των παύλων. Εάν θέλετε, μπορείτε να δείτε πώς να το γράψετε με περισσότερες λεπτομέρειες στο κείμενο Μοριακοί τύποι οργανικών ενώσεων. Αλλά βασικά, σε αυτόν τον τύπο, οι ομάδες C, CH, CH παραλείπονται2 και CH3, που αντιπροσωπεύονται από παύλες συνδεδεμένες με ζιγκ-ζαγκ. Παρακάτω έχουμε τον συντακτικό τύπο του προαναφερθέντος αιθέρα:
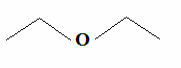
Κοινή φόρμουλα Ether Trace
Είναι αλήθεια, ωστόσο, ότι οι φόρμουλες ουσιών δεν είναι ακριβώς επίπεδες στο διάστημα. Επομένως, σε ορισμένες περιπτώσεις, για να δώσουν μια πιο χωρική ιδέα, γράφουν τύποι σε προοπτική, όπου οι σύνδεσμοι μπορούν να υποδεικνύουν εάν το άτομο βρίσκεται στο επίπεδο (κανονική διαδρομή), πίσω από το επίπεδο (στικτή διάστικτη) ή μπροστά από το επίπεδο (πλήρης σφήνα):

Παραστάσεις σε προοπτικές τύπων
Για παράδειγμα, ρίξτε μια ματιά στον παρακάτω τύπο κορτιζόλης. Σημειώστε ότι ένα υδρογόνο, μία ομάδα υδροξυλίου (ΟΗ) και δύο ομάδες μεθυλίου (CH3 - που παραλείπονται) βρίσκονται μπροστά από το επίπεδο, ενώ δύο υδρογόνα και μια ομάδα υδροξυλίου βρίσκονται πίσω από το επίπεδο, και τα υπόλοιπα βρίσκονται στο επίπεδο.

Δομικός τύπος με προοπτική κορτιζόλης
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-formula-estrutural.htm
