Αντιδράσεις μείωσης οξείδωσης που εμφανίζονται παρουσία υπεροξειδίου του υδρογόνου (υδατικό διάλυμα υπεροξειδίου του υδρογόνου - H2Ο2 (υδ)) αποτελούν μια ειδική περίπτωση που πρέπει να αναλυθεί ξεχωριστά, κυρίως όσον αφορά την ισορροπία της. Αυτό συμβαίνει επειδή τα οξυγόνα στο υπεροξείδιο του υδρογόνου, τα οποία έχουν Nox ίσο με -1, μπορούν είτε να οξειδωθούν είτε να μειωθούν.
Για παράδειγμα, ας δούμε δύο περιπτώσεις στις οποίες συμπεριφέρεται πρώτα ως οξειδωτικός παράγοντας (αναγωγικός) και έπειτα ως αναγωγικός παράγοντας (οξειδωτικό):
- μέσο οξείδωσης: όποτε μειώνεται το υπεροξείδιο του υδρογόνου, ενεργώντας ως οξειδωτικός παράγοντας, παράγει νερό ως προϊόν.
Εάν προσθέσουμε ένα διάλυμα υπεροξειδίου του υδρογόνου σε ένα διάλυμα που περιέχει ιόντα ιωδιούχου (I-) σε όξινο μέσο, θα έχουμε:
Η2Ο2 (υδ) + Εγώ-(εδώ) + Χ+(εδώ) → Η2Ο(1) + Εγώ2 (α)
Δείτε ότι σχηματίζονται νερό και ιώδιο. Αλλά για να ελέγξετε αν το υπεροξείδιο του υδρογόνου έδρασε πραγματικά ως οξειδωτικό μέσο και μειώθηκε, παρατηρήστε τον προσδιορισμό των αριθμών οξείδωσης (NOx): *

Το οξυγόνο Νο του υπεροξειδίου του υδρογόνου μειώθηκε από -1 σε -2, δεδομένου ότι δέχθηκε 1 ηλεκτρόνιο. Ωστόσο, καθώς έχουμε δύο οξυγόνα σε κάθε μόριο υπεροξειδίου του υδρογόνου (Η2Ο2), η παραλλαγή Nox θα είναι ίση με 2.
Έτσι, όπως φαίνεται στο κείμενο "Εξισορρόπηση Redox", Ένα απαραίτητο βήμα για την εξισορρόπηση των αντιδράσεων με τη μέθοδο μείωσης της οξείδωσης είναι η αντιστροφή των τιμών των παραλλαγών του Nox από τους συντελεστές, στην περίπτωση αυτή, ως εξής:
* Χ2Ο2 = 2 (ΔNox) = 2 → 2 θα είναι ο συντελεστής του I-;
* ΕΓΩ-= ΔNox = 1 → 1 θα είναι ο συντελεστής H2Ο2.
Έτσι, έχουμε:
1 ώρα2Ο2 (υδ) + 2 Ι-(εδώ) + Χ+(εδώ) → Η2Ο(1) + Εγώ2 (α)
Χτυπώντας τους άλλους συντελεστές εξισορροπώντας με δοκιμές:
- Δεδομένου ότι υπάρχουν δύο άτομα οξυγόνου στο 1ο μέλος, ο συντελεστής νερού στο 2ο μέλος πρέπει να είναι ίσος με 2. Και δεδομένου ότι υπάρχουν επίσης δύο ιόντα ιωδίου στο 1ο μέλος, ο συντελεστής ιωδίου στο 2ο μέλος θα είναι 1. Μην ξεχνάτε ότι πρέπει να πολλαπλασιάσουμε τον δείκτη με τον συντελεστή για να βρούμε τη σωστή ποσότητα ατόμων και ιόντων σε κάθε μέλος:
1 ώρα2Ο2 (υδ) + 2 Ι-(εδώ) + Χ+(εδώ) → 2 Ω2Ο(1) + 1 εγώ2 (α)
- Τώρα απομένει μόνο να εξισορροπηθεί το κατιόν υδρογόνου του 1ου μέλους και ο συντελεστής του θα πρέπει να είναι ίσος με 2, επειδή στο 2ο μέλος έχει 4 υδρογόνα και στο 1ο μέλος έχει ήδη δύο:
1 ώρα2Ο2 (υδ) + 2 Ι-(εδώ) +2 Ω+(εδώ) → 2 Ω2Ο(1) + 1 εγώ2 (α)
- αναγωγικό μέσο: όποτε το υπεροξείδιο του υδρογόνου οξειδώνεται, ενεργώντας ως αναγωγικός παράγοντας, παράγει οξυγόνο (Ο2) ως προϊόν.
Ένα παράδειγμα όπου το υπεροξείδιο του υδρογόνου μειώνεται είναι όταν έρχεται σε επαφή με υπερμαγγανικό κάλιο (KMnO4). Αυτή η ουσία έχει ένα πολύ χαρακτηριστικό ιώδες χρώμα, αλλά όταν έρχεται σε επαφή με το υπεροξείδιο του υδρογόνου γίνεται άχρωμο. Αυτό συμβαίνει επειδή όλα τα μαγγάνιο υπάρχουν στο ιόν MnO4- του υπερμαγγανικού διαλύματος μειώνεται, δημιουργώντας το ιόν Μη2+, όπως φαίνεται παρακάτω:
+1 -1 +7 -2 +1 0 +2 +1 -2
Η2Ο2 + Μη4-+ Χ+ → Το2 + Μη2++ Χ2Ο
Υπολογίζοντας το Nox, βλέπουμε ότι το οξυγόνο στο υπεροξείδιο του υδρογόνου οξειδώνεται και προκαλεί τη μείωση του μαγγανίου:
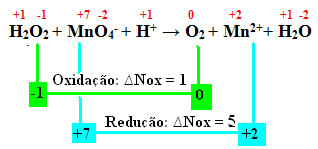
Όπως και στο προηγούμενο παράδειγμα, το ΔNox του υπεροξειδίου του υδρογόνου θα είναι ίσο με το 2, καθώς υπάρχουν δύο οξυγόνα και το καθένα χάνει ένα ηλεκτρόνιο. Επομένως, έχουμε:
* Ο2 = 2 (ΔNox) = 2 → 2 θα είναι ο συντελεστής του MnO4-;
* ΜΝΟ4- = ΔNox = 5 → 5 θα είναι ο συντελεστής του O2.
Και όπως όλα τα O2 προέρχεται από υπεροξείδιο του υδρογόνου, οι δύο ουσίες έχουν τον ίδιο συντελεστή:
5 Η2Ο2 + 2ΜΝΟ4-+ Χ+ → 5 Ο2 + Μη2++ Χ2Ο
Ισορροπώντας με τη δοκιμαστική μέθοδο, έχουμε:
5 ώρες2Ο2 + 2 εκατ. Ευρώ4-+ 6 Ω+ → 5 O2 + 2 εκατ2++ 8 Ω2Ο
* Για οποιεσδήποτε ερωτήσεις σχετικά με τον τρόπο υπολογισμού του αριθμού οξείδωσης (Nox) ατόμων και ιόντων σε μια αντίδραση, διαβάστε το κείμενο "Προσδιορισμός του αριθμού οξείδωσης (Nox)".
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm
