Στο συνηθισμένες μπαταρίες λέγονται Μπαταρίες Leclanché πήρε το όνομά του από τον εφευρέτη του, τον Γάλλο χημικό George Leclanché (1839-1882).

Τζορτζ Λεκλάντσε (1839-1882)
Η Leclanché δημιούργησε αυτόν τον τύπο μπαταρίας το 1866. Λέγεται επίσης ξερό κύτταρο γιατί μέχρι τότε υπήρχαν μόνο μπαταρίες που χρησιμοποιούσαν υδατικά διαλύματα, όπως Ο σωρός του Ντάνιελ.
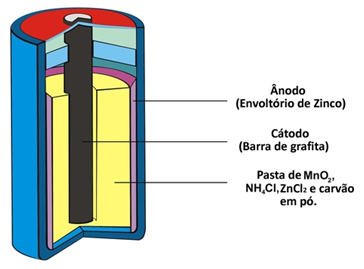
Δύο άλλα ονόματα που λαμβάνει αυτός ο τύπος σωρού λόγω της σύνταξής του είναι όξινος σωρός ή μπαταρία άνθρακα ψευδαργύρου. Σχηματίζεται βασικά από μια επικάλυψη ψευδαργύρου που διαχωρίζεται από τα άλλα χημικά είδη που συνθέτουν το σωρό μέσω πορώδους χαρτιού.
Αυτός ο ψευδάργυρος αντιστοιχεί στον αρνητικό πόλο του κυττάρου ή της ανόδου, καθώς οξειδώνεται, χάνοντας δύο ηλεκτρόνια, σύμφωνα με την παρακάτω ημι-αντίδραση:
Αρνητικός πόλος - Άνοδος: Zn (μικρό) → Zn2+(εδώ) +2 και-
Αυτός ο σωρός έχει επίσης έναν θετικό πόλο, την κάθοδο, η οποία είναι μια ράβδος γραφίτη εγκατεστημένη στη μέση του σωρού που περιβάλλεται από διοξείδιο του μαγγανίου (MnO
2), κονιοποιημένος άνθρακας (C) και υγρή πάστα που περιέχει χλωριούχο αμμώνιο (NH)4Cl), χλωριούχος ψευδάργυρος (ZnCl2) και νερό (Η2Ο).Το χλωριούχο αμμώνιο και το χλωριούχο ψευδάργυρο είναι άλατα με όξινο χαρακτήρα, εξ ου και η ονομασία «όξινο κύτταρο».
Η ράβδος γραφίτη οδηγεί τα ηλεκτρόνια που χάνονται από τον ψευδάργυρο στο μαγγάνιο, μειώνοντας το διοξείδιο του μαγγανίου (MnO)2) προς το τριοξείδιο του μαγγανίου (Μη2Ο3), σύμφωνα με την ακόλουθη ημι-αντίδραση:
Θετικός πόλος - Κάθοδος: 2 MnO2 (υδ) + 2 ΝΗ41+(εδώ) + 2ε- → 1 εκατ2Ο3(μικρό) + 2ΝΗ3 (ζ) + 1 ώρα2Ο(1)
Η υγρή πάστα δρα ως σημείο αλάτι, επιτρέποντας τη μετανάστευση των υδροξυλ ανιόντων (ΟΗ-) από γραφίτη έως ψευδάργυρο.
Η συνολική αντίδραση δίνεται από:
Ζν (μικρό) + 2 εκατ. Ευρώ2 (υδ) + 2 ΝΗ41+(εδώ) → Zn2+(εδώ) + 1 εκατ2Ο3(μικρό) + 2ΝΗ3 (ζ)
Ως εκ τούτου, αυτές οι μπαταρίες δεν είναι επαναφορτιζόμενες καθώς όλο το διοξείδιο του μαγγανίου μετατρέπεται σε τριοξείδιο του μαγγανίου. Όταν η μπαταρία σταματήσει να λειτουργεί, πρέπει να απορριφθεί.
Το ddp αυτών των μπαταριών είναι 1,5V. Ωστόσο, αμμωνία (NH3 (ζ)) που σχηματίζεται στην κάθοδο μπορεί να εναποτεθεί στη ράβδο γραφίτη, εμποδίζοντας τη διέλευση των ηλεκτρονίων και μειώνοντας την τάση της μπαταρίας. Για να επιστρέψετε στην κανονική λειτουργία, αφήστε την μπαταρία να ξεκουραστεί έξω από τη συσκευή, όπως το κατιόν ψευδάργυρου (Zn2+(εδώ)) που σχηματίζεται στην άνοδο αντιδρά με αμμωνία, αφήνοντας τη ράβδο γραφίτη ελεύθερη.
Επιπλέον, η τοποθέτηση του σωρού στο ψυγείο μπορεί επίσης να βοηθήσει, καθώς η μείωση της θερμοκρασίας ευνοεί τη διαλυτότητα της αμμωνίας στην υγρή πάστα στο σωρό.
Ένας άλλος σημαντικός παράγοντας για τα ξηρά κύτταρα Leclanché που πρέπει να λάβουμε υπόψη είναι ότι το περίβλημα ψευδαργύρου μπορεί να διαβρώσει και έτσι να διαρρεύσει το διαβρωτικό υλικό και να προκαλέσει ζημιά στη συσκευή.. Επομένως, το καλύτερο που πρέπει να κάνετε είναι να μην αφήσετε τις μπαταρίες μέσα σε συσκευές που δεν χρησιμοποιούνται συνεχώς.
Οι ξηρές μπαταρίες ενδείκνυνται για εξοπλισμό που απαιτεί ελαφριά και συνεχή εκφόρτιση, όπως τηλεχειριστήριο, ρολόι τοίχου, φορητό ραδιόφωνο και παιχνίδια.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/pilha-seca-leclanche.htm