Το 1786, ο Ιταλός ανατομιστής Luigi Galvani (1737-1798) διέκοψε έναν βάτραχο στο τραπέζι του, στον οποίο ήταν μια ηλεκτροστατική μηχανή. Ο Galvani παρακολούθησε τους μυς του ζώου να συστέλλονται καθώς ο βοηθός του άγγιξε κατά λάθος την άκρη του νυστέρι του στο εσωτερικό νεύρο του μηρού του βατράχου. Με άλλα λόγια, αυτό συνέβη όταν οι ιστοί του βατράχου ακουμπήθηκαν από δύο διαφορετικά μέταλλα.
Ο Galvani άρχισε να υπερασπίζεται, από εκείνη τη στιγμή, μια θεωρία που προσπάθησε να εξηγήσει αυτό το γεγονός: τη θεωρία της «ηλεκτρικής ενέργειας των ζώων». Σύμφωνα με τον Γκαλβάνι, τα μέταλλα ήταν απλώς αγωγοί ηλεκτρικής ενέργειας, που στην πραγματικότητα θα περιέχονται στους μυς του βατράχου.
Ωστόσο, η θεωρία του ήταν λανθασμένη και αυτό το είδε ο Ιταλός φυσικός Alessandro Volta (1745-1827), ο οποίος πραγματοποίησε διάφορα πειράματα και παρατήρησε ότι όταν η πλάκα και το σύρμα ήταν κατασκευασμένα από το ίδιο μέταλλο, οι σπασμοί δεν εμφανίστηκαν, δείχνοντας ότι δεν υπήρχε ροή ηλεκτρική ενέργεια. Έτσι, προχώρησε στην υπεράσπιση της (σωστής) έννοιας ότι ο ηλεκτρισμός δεν προήλθε από τους μυς του βατράχου, αλλά από μέταλλα και ότι οι ιστοί του ζώου έκαναν αυτήν την ηλεκτρική ενέργεια.
Για να αποδείξει ότι ήταν σωστός, ο Volta έκανε ένα κύκλωμα που σχηματίστηκε από ένα ηλεκτρολυτικό διάλυμα, δηλαδή ένα διάλυμα με ιόντα διαλυμένο, το οποίο ονόμασε υγρό αγωγό ή αγωγό δεύτερης κατηγορίας, σε επαφή με δύο ηλεκτρόδια μεταλλικός. Αυτά τα τελευταία, ο Alessandro Volta ονόμασαν ξηρούς αγωγούς ή αγωγούς πρώτης κατηγορίας.
Το έκανε αυτό τοποθετώντας έναν υγρό αγωγό (που ήταν ένα υδατικό αλατούχο διάλυμα) μεταξύ δύο ξηρών αγωγών (που ήταν μέταλλα συνδεδεμένα με ένα αγώγιμο σύρμα). Εκείνη τη στιγμή παρατήρησε ότι η ηλεκτρική ροή ξύπνησε. Κατάλαβε επίσης ότι ανάλογα με τα μέταλλα που χρησιμοποίησε, η τρέχουσα ροή μπορεί να είναι μεγαλύτερη ή μικρότερη. Έτσι, μπορούμε να παραδεχτούμε ότι η ιδέα του τι είναι ένας σωρός είχε ήδη κατανοηθεί και εξηγηθεί από τη Volta.
Το 1800 η Volta δημιούργησε το πρώτο ηλεκτρικό κελί, το οποίο ονομάστηκε πίσω στοίβα, γαλβανικός σωρός ή ηλιακό κύτταρο και ακόμα, "κομπολόι". Ένα σχήμα αυτού του σωρού φαίνεται παρακάτω: τοποθέτησε έναν δίσκο χαλκού πάνω από έναν δίσκο τσόχα εμποτισμένο με ένα διάλυμα θειικού οξέος, και τέλος έναν δίσκο ψευδαργύρου. και ούτω καθεξής, στοίβαγμα αυτών των σειρών σε μια μεγάλη στήλη. Ο χαλκός, η τσόχα και ο ψευδάργυρος είχαν μια τρύπα στη μέση και σπειρώθηκαν σε μια οριζόντια ράβδο, συνδέοντας έτσι ένα αγώγιμο σύρμα.
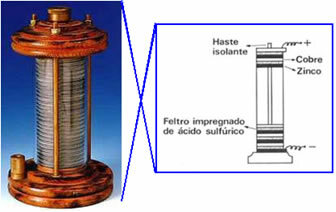
Αυτό το πείραμα προκάλεσε αναταραχές στον επιστημονικό κόσμο και από τότε σε όλες τις συσκευές που παρήγαγαν ηλεκτρισμό από διεργασίες χημικές ουσίες (δηλαδή, που παρήγαγε χημική ενέργεια σε ηλεκτρική ενέργεια) ονομάστηκαν ηλιακά κύτταρα, γαλβανικά κύτταρα ή, απλά, μπαταρίες.
Η Volta έκανε το ίδιο πείραμα με διαφορετικά μέταλλα και διαλύματα ηλεκτρολυτών, όπως δίσκους ασημιού και ψευδαργύρου που διαχωρίστηκαν με δίσκους φλάντζας με άλμη. Έκανε ακόμη μια επίδειξη αυτής της ανακάλυψης για τον Ναπολέοντα Βοναπάρτη, όπως φαίνεται στο παρακάτω σχήμα, στην Ακαδημία Επιστημών του Παρισιού.

Ο Alessandro Volta καταδεικνύει την ανακάλυψή του στον Ναπολέοντα
Ένα άλλο πείραμα της Volta με μπαταρίες ήταν το στεφάνι από γυαλιά, στην οποία τοποθέτησε δύο πλάκες διαφορετικών μετάλλων που διασυνδέονται με ένα αγώγιμο σύρμα, αλλά χωρίζονται με διαλύματα ηλεκτρολυτών.
Γνωρίζουμε επί του παρόντος ότι αυτό που συμβαίνει σε ένα κελί, όπως αυτά που δημιουργήθηκαν από τη Volta, είναι ότι η ηλεκτρική ενέργεια ρέει από τον πόλο. αρνητική, που ονομάζεται άνοδος, η οποία οξειδώνεται, χάνοντας ηλεκτρόνια στο θετικό πόλο, που ονομάζεται κάθοδος, η οποία μειώνει, κερδίζοντας ηλεκτρόνια.
Αυτές οι μπαταρίες που κατασκευάζονται σε υδατικό διάλυμα δεν χρησιμοποιούνται σήμερα. μόνο από την άποψη της έρευνας, αλλά ήταν η αρχή που ανέπτυξε τις σύγχρονες μπαταρίες που γνωρίζουμε σήμερα ως μπαταρίες που είναι πολύ πιο πρακτικό στη χρήση και μεταφορά και παρέχουν ικανοποιητικό ηλεκτρικό ρεύμα για πολύ περισσότερα. χρόνος.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/historia-das-pilhas.htm
