Οι αναστρέψιμες αντιδράσεις συνήθως ξεκινούν με μια ορισμένη ποσότητα αντιδραστηρίων. Καθώς ξεκινά η άμεση αντίδραση, με την πάροδο του χρόνου, αυτά τα αντιδραστήρια καταναλώνονται για το σχηματισμό των προϊόντων, κατά συνέπεια η συγκέντρωση των αντιδραστηρίων μειώνεται ενώ η συγκέντρωση των προϊόντων αυξάνεται. Στη συνέχεια, ξεκινά επίσης η αντίστροφη αντίδραση, παράγοντας και τα αντιδραστήρια, έως ότου ο ρυθμός ανάπτυξης (ταχύτητα) των άμεσων και αντίστροφων αντιδράσεων παραμείνει ο ίδιος, φτάνοντας στο λεγόμενο χημική ισορροπία.
Στην ισορροπία, υπάρχει η σταθερά ισορροπίας Kc, η οποία βασικά εκφράζεται από:
|
Κc = [προϊόντα]συντελεστής ισορροπημένης χημικής εξίσωσης [αντιδραστήρια]συντελεστής ισορροπημένης χημικής εξίσωσης |
Δηλαδή, λαμβάνοντας υπόψη την ακόλουθη γενική αντίδραση ισορροπίας:
a A + b B ↔ c C + d D
Δεδομένου ότι τα πεζά γράμματα είναι οι συντελεστές και τα κεφαλαία γράμματα είναι οι ουσίες, η σταθερά ισορροπίας αυτής της αντίδρασης θα είναι:
Κc = [ΝΤΟ]ντο. [ΡΕ]ρε
[Ο]ο. [ΣΙ]σι
Περισσότερες λεπτομέρειες σχετικά με αυτό μπορείτε να δείτε στο κείμενο Σταθερές ισορροπίας Kc και Kp. Αυτό το κείμενο μας δείχνει επίσης κάτι σημαντικό: ότι οι τιμές Kc μπορούν να μας δείξουν εάν η συγκέντρωση των αντιδραστηρίων και το τα προϊόντα είναι ίδια ή εάν το ένα είναι μεγαλύτερο από το άλλο και, κατά συνέπεια, εάν η χημική ισορροπία μετατοπιστεί σε κάποια κατεύθυνση αντίδραση.
Πρέπει λοιπόν να προσδιορίσουμε την τιμή του Kc. Για να το κάνετε αυτό, θυμηθείτε ότι αυτοί οι υπολογισμοί είναι πειραματικοί, οπότε ας δούμε μερικά παραδείγματα αντιδράσεων και τα δεδομένα που λαμβάνονται από αυτές.
Κάτι που είναι πολύ χρήσιμο στην εκτέλεση αυτών των υπολογισμών είναι να γράψετε έναν πίνακα παρόμοιο με αυτόν που φαίνεται παρακάτω και να ακολουθήσετε τα βήματα που αναφέρονται σε αυτό:

Πίνακας για την οργάνωση των δεδομένων που χρησιμοποιούνται για τον υπολογισμό της σταθεράς ισορροπίας
Τώρα, ας πάμε στην εξάσκηση:
Παράδειγμα 1: Σε κλειστό δοχείο, χωρητικότητας 2 L, σε θερμοκρασία 100 ° C, υπάρχουν 20 mol Ν2Ο4. Η ακόλουθη αναστρέψιμη αντίδραση αρχίζει να εμφανίζεται: Ν2Ο4 ↔ ΟΧΙ2. Μετά από κάποιο χρονικό διάστημα, βρέθηκε ότι η αντίδραση έφτασε σε χημική ισορροπία και ότι 8 mol ΝΟ2 είχε σχηματιστεί. Ποια είναι η τιμή της σταθεράς ισορροπίας Kc σε θερμοκρασία 100 ° C;
Ανάλυση:
Ας χρησιμοποιήσουμε τον πίνακα:

Πίνακας που χρησιμοποιείται για την επίλυση παραδείγματος σταθερού υπολογισμού ισορροπίας
Σημειώστε ότι στη γραμμή όπου γράφτηκαν οι ποσότητες που αντιδρούν και σχηματίζονται, ξέρουμε ότι ξοδεύτηκαν 4 γραμμομόρια Ν2Ο4, επειδή η αναλογία είναι 1: 2, και ότι σχηματίστηκαν 8 mol ΝΟ2.
Τώρα απλώς αντικαταστήστε τις τιμές που βρέθηκαν στην έκφραση της σταθεράς ισορροπίας Kc αυτής της αντίδρασης:
Κc = [ΣΤΟ2]2
[Ν2Ο4]
Κc = (4 mol / L) 2
(8 mol / L)
Kc = 2 mol / L
Η τιμή του Kc είναι χωρίς διάσταση, δεν έχει καμία μονάδα που να σχετίζεται με οποιοδήποτε μέγεθος.
Τώρα, ας δούμε ένα παράδειγμα, το οποίο περιέχει επίσης προϊόντα από την αρχή:
Παράδειγμα 2: Σε κλειστό δοχείο, χωρητικότητας 5 L, σε θερμοκρασία Τ, υπάρχουν 2 γραμμομόρια αερίου υδρογόνου, 3 γραμμομόρια αερίου ιωδίου και 4 γραμμομόρια ιωδιούχου υδρογόνου. Η αντίδραση εισέρχεται σε χημική ισορροπία, σε θερμοκρασία Τ, και αποδεικνύεται ότι υπάρχει 1 γραμμομόριο αερίου υδρογόνου στο δοχείο. Ποιο είναι το γράφημα που αντιπροσωπεύει αυτήν την ισορροπία και ποια είναι η τιμή της σταθεράς ισορροπίας Kc στη θερμοκρασία του Τ;
Ανάλυση:
Χρήση πίνακα:
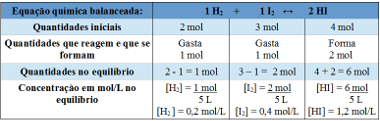
Πίνακας που χρησιμοποιείται για τον προσδιορισμό της σταθεράς ισορροπίας
Το γράφημα που δείχνει τις διακυμάνσεις των συγκεντρώσεων αντιδραστηρίων και προϊόντων mol / L έως ότου φθάσουν στην ισορροπία μπορεί να δοθεί από:

Γράφημα χημικής ισορροπίας που δείχνει αλλαγές στις συγκεντρώσεις αντιδραστηρίων και προϊόντων
Τώρα βρίσκουμε την τιμή της σταθεράς ισορροπίας:
Κc = __ [HI]2__
[Χ2 ]. [ΕΓΩ2]
Κc = (1,2)2
0,2. 0,4
Κc = 18
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm



