Ο ιωνικός δεσμός εμφανίζεται μεταξύ των ιόντων, όπως υποδηλώνει το όνομά του. Επειδή έχουν αντίθετα φορτία, τα κατιόντα (στοιχείο με θετικό φορτίο) και ανιόντα (στοιχείο με αρνητικό φορτίο) προσελκύουν το ένα το άλλο ηλεκτροστατικά, σχηματίζοντας τον δεσμό. Ωστόσο, ένα ιοντικό στερεό αποτελείται από ένα συσσωμάτωμα κατιόντων και ανιόντων οργανωμένων με καλά καθορισμένα γεωμετρικά σχήματα, που ονομάζονται πλέγματα ή κρυσταλλικά πλέγματα.
Για παράδειγμα, το άλας (χλωριούχο νάτριο) σχηματίζεται από την οριστική μεταφορά ενός ηλεκτρονίου από νάτριο σε χλώριο, δημιουργώντας το κατιόν νατρίου (Na+) και το χλωριούχο ανιόν (Cl-). Στην πράξη, αυτή η αντίδραση περιλαμβάνει όχι μόνο δύο άτομα, αλλά έναν τεράστιο και απροσδιόριστο αριθμό ατόμων που σχηματίζουν ένα κρυσταλλικό πλέγμα κυβικού σχήματος, όπως φαίνεται παρακάτω:
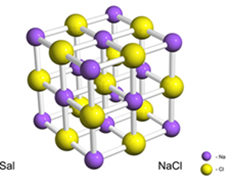
Αν κοιτάξουμε τους κρυστάλλους αλατιού με ένα ηλεκτρονικό μικροσκόπιο σάρωσης, θα δούμε ότι είναι πραγματικά κυβικά λόγω της εσωτερικής τους δομής.

Δεδομένου ότι κάθε ιοντική ένωση αποτελείται τότε από έναν απροσδιόριστο και πολύ μεγάλο αριθμό ιόντων, πώς μπορούμε να αντιπροσωπεύσουμε μια ιοντική ένωση;
Ο τύπος που χρησιμοποιείται συνήθως είναι το τύπος μονάδας, που είναι αυτό αντιπροσωπεύει την αναλογία που εκφράζεται με τον μικρότερο δυνατό αριθμό κατιόντων και ανιόντων που αποτελούν το κρυσταλλικό πλέγμα, έτσι ώστε το συνολικό φορτίο της ένωσης να εξουδετερώνεται. Για να συμβεί αυτό είναι απαραίτητο ο αριθμός των ηλεκτρονίων που παραδίδονται από ένα άτομο να είναι ίσος με τον αριθμό των ηλεκτρονίων που λαμβάνονται από το άλλο άτομο.
Ορισμένες πτυχές σχετικά με τον τύπο μονάδας των ιοντικών ενώσεων είναι σημαντικές, δείτε μερικές:
- Πάντα γράψτε το κατιόν πρώτα και μετά το ανιόν.
- Δεδομένου ότι κάθε ιοντική ένωση είναι ηλεκτρικά ουδέτερη, τα μεμονωμένα φορτία ιόντων δεν χρειάζεται να καταγραφούν.
- Οι αριθμοί συνδρομής που εμφανίζονται στη δεξιά πλευρά κάθε ιόντος υποδεικνύουν την αναλογία των ατόμων του κατιόντος προς το ανιόν. Αυτοί οι αριθμοί ονομάζονται δείκτες και ο αριθμός 1 δεν είναι γραμμένος.
Για παράδειγμα, στην περίπτωση του χλωριούχου νατρίου, έχουμε ότι ο τύπος μονάδας του είναι NaCl, καθώς έχουμε ακριβώς 1 κατιόν νατρίου για κάθε ανιόν χλωριδίου.
Δείτε ένα άλλο παράδειγμα, Al3+ έχει τρία θετικά φορτία, ενώ το F- έχει μόνο ένα αρνητικό, επομένως χρειάζονται τρία ανιόντα φθορίου για την εξουδετέρωση της ένωσης. Έτσι, καταλήγουμε στο συμπέρασμα ότι ο τύπος μονάδας του είναι AlF3.
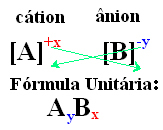
Ένας απλός τρόπος για να φτάσετε στον τύπο μονάδας της ιονικής ένωσης είναι να ανταλλάξετε τις χρεώσεις της με τους δείκτες της, όπως φαίνεται με έναν γενικό τρόπο παρακάτω:
Παραδείγματα:

Ένας άλλος τύπος που χρησιμοποιείται για την αναπαράσταση ιοντικών ουσιών είναι το Τύπος Lewis ή ηλεκτρονικός τύπος, τι αντιπροσωπεύει τα ηλεκτρόνια από το κέλυφος σθένους των ιόντων "σφαιρών" γύρω από το σύμβολο του στοιχείου. Στην περίπτωση του αλατιού, έχουμε:

Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm