Τα ανθρακικά άλατα είναι ανόργανες ενώσεις που σχηματίζονται από την ιοντική σύνδεση ενός μετάλλου ή ημιμετάλλου με το ανθρακικό ανιόν, CO32-.
Ο άνθρακας είναι τετρασθενής, δηλαδή έχει τέσσερα ηλεκτρόνια στο κέλυφος σθένους και μπορεί να κάνει τέσσερις ομοιοπολικούς δεσμούς να είναι σταθεροί, ενώ το οξυγόνο είναι δισθενές, έχει έξι ηλεκτρόνια στο κέλυφος σθένους και είναι σε θέση να κάνει δύο δεσμούς να είναι σταθεροί, με οκτώ ηλεκτρόνια. Έτσι, υπάρχει μια ισχυρή τάση να συνδέεται ένας άνθρακας με δύο άτομα οξυγόνου, τα οποία είναι όλα σταθερά (Ο ═ C ═ Ο → CO2).
Αλλά άλλο οξυγόνο μπορεί να συνδυαστεί με άνθρακα, καθώς η αναλογία των ιοντικών ακτίνων οδηγεί σε έναν αριθμό συντονισμού ίσο με 3, σχηματίζοντας μια δομή τριγωνικό στο οποίο ο άνθρακας βρίσκεται στο κέντρο, δημιουργώντας έναν διπλό δεσμό με ένα από τα άτομα οξυγόνου και δύο μοναδικούς δεσμούς με τα άλλα δύο οξυγόνα. Το αποτέλεσμα είναι δύο υπερβολικά ηλεκτρόνια, καθώς αυτά τα δύο οξυγόνα δεν είναι σταθερά, πρέπει να λαμβάνουν ένα ηλεκτρόνιο το καθένα:
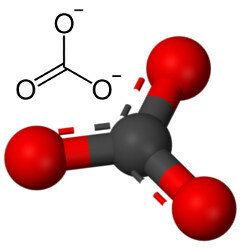
Το ανθρακικό ανιόν σχηματίζεται από ομοιοπολικούς δεσμούς, αλλά οι ενώσεις του, τα οποία είναι ανόργανα άλατα και μέταλλα γνωστά ως ανθρακικά άλατα, είναι ιονικά, καθώς αυτή η ρίζα δέχεται δύο ηλεκτρόνια από κάποιο μέταλλο ή ημιμεταλλικό, σχηματίζοντας ένα ιοντικός δεσμός.
Αυτές οι ενώσεις είναι αδιάλυτες στο νερό, με εξαίρεση το ανθρακικό αμμώνιο ((NH)4)2CO3) και ανθρακικά άλατα που σχηματίζονται με αλκαλικά μέταλλα (στοιχεία της οικογένειας 1: Li, Na, K, Rb, Cs και Fr). Σχεδόν όλα είναι λευκά στερεά, όπως φαίνεται στην παρακάτω εικόνα:

Τα δύο πιο κοινά και πιο σημαντικά καθημερινά παραδείγματα ανθρακικών είναι το ανθρακικό νάτριο (Na2CO3) και ανθρακικό ασβέστιο (CaCO3). Στην πρώτη περίπτωση, το νάτριο ανήκει στην οικογένεια 1, που έχει ένα ηλεκτρόνιο στο κέλυφος σθένους και τείνει να χάσει αυτό το ηλεκτρόνιο για να γίνει σταθερό. Καθώς το ανθρακικό ανιόν πρέπει να δέχεται δύο ηλεκτρόνια, συνδέεται με δύο άτομα νατρίου:

Η ανθρακική τέφρα είναι περισσότερο γνωστή ως σόδα ή σόδα και χρησιμοποιείται στην παρασκευή σαπουνιών, βαφών, φαρμάκων, χαρτιού και στην επεξεργασία του νερού της πισίνας. Αλλά η κύρια εφαρμογή του είναι με ανθρακικό ασβέστιο και άμμο στην κατασκευή γυαλιού.
Το ασβέστιο είναι οικογένεια 2, έχει την τάση να χάνει δύο ηλεκτρόνια. Έτσι, ένα άτομο ασβεστίου συνδέεται με μια ανθρακική ρίζα:

Το ανθρακικό ασβέστιο υπάρχει σε ασβεστόλιθο και μάρμαρο. Στο σταλακτίτες και σταλαγμίτες που υπάρχουν σε σπηλιές αποτελούνται από αυτό το ανθρακικό. κοχύλια, κοραλλιογενείς υφάλους και κελύφη αυγών. Όταν πλένουμε τοίχους, κορμούς δέντρων και άλλα μέρη, χρησιμοποιούμε υδροξείδιο του ασβεστίου (Ca (OH)2), που με την πάροδο του χρόνου αντιδρά με το ατμοσφαιρικό διοξείδιο του άνθρακα για να σχηματίσει ανθρακικό ασβέστιο.

Τα ανθρακικά άλατα είναι πολύ κοινά στην επιφάνεια της Γης, όπως στην περίπτωση των ορυκτών. Το κρυσταλλικό του δίκτυο μπορεί να αναδιατάξει στο διάστημα με δύο τρόπους: το ορθορομβικό (όπως συμβαίνει με τον ορυκτό αραγονίτη που φαίνεται παραπάνω μαζί με τον τύπο ανθρακικού ασβεστίου) και το ρομβοεδρικός ή τριγωνικός, όπως στην περίπτωση του ασβεστίτη (άλλο μέταλλο που αποτελείται από ανθρακικό ασβέστιο).
Τα ανθρακικά αντιδρούν παρουσία οξέων, απελευθερώνοντας CO2, το οποίο φαίνεται εύκολα μέσω ενός αναβρασμού.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
