Στο λειτουργία οξυγόνου είναι μια ομάδα από ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ που έχουν άτομα οξυγόνου συνδεδεμένα με την αλυσίδα άνθρακα. Είναι αυτοί:
αλκοόλ;
κετόνη;
αλδεγύδη;
καρβοξυλικό οξύ;
αστήρ;
αιθέρας.
Διαβάστε επίσης:Υδρογονάνθρακες — ενώσεις που αποτελούνται από άνθρακα και υδρογόνο
Περίληψη για τη λειτουργία του οξυγόνου
Οι συναρτήσεις οξυγόνου είναι μια ομάδα ενώσεων που περιέχουν ένα άτομο οξυγόνου. οξυγόνο συνδέεται απευθείας στην αλυσίδα άνθρακα.
Οι διαφορετικές λειτουργίες οξυγόνου χαρακτηρίζονται από μια συγκεκριμένη δομική διάταξη του άτομα, που ονομάζεται λειτουργική ομάδα.
Οι λειτουργικές ομάδες είναι υπεύθυνες για τις ιδιότητες κάθε οργανικής λειτουργίας.
Οι λειτουργίες του οξυγόνου είναι: αλκοόλη, κετόνη, αλδεΰδη, καρβοξυλικό οξύ, εστέρας και αιθέρας.
Βίντεο μάθημα για τη λειτουργία οξυγόνου
Ποιες είναι οι λειτουργίες του οξυγόνου;
Οι οξυγονωμένες λειτουργίες του σώματος είναι αυτές που έχουν ένα άτομο οξυγόνου συνδεδεμένο με ένα άτομο οξυγόνου άνθρακας της αλυσίδας άνθρακα.
Οι λειτουργίες του οξυγόνου είναι:
αλκοόλ;
κετόνη;
αλδεγύδη;
καρβοξυλικό οξύ;
αστήρ;
αιθέρας.
Οι οργανικές λειτουργίες προσδιορίζονται από τη λειτουργική τους ομάδα, που είναι μια δομική διάταξη ατόμων ή δεσμών, υπεύθυνη για τις χαρακτηριστικές ιδιότητες αυτού του συνόλου ενώσεων.
Σημασία των λειτουργιών οξυγόνου
Η παρουσία οξυγόνου λειτουργεί σε οργανικές ενώσεις είναι σε θέση να αλλάζει τις ιδιότητες των ενώσεων, σε σύγκριση με τον αντίστοιχο υδρογονάνθρακα, με ίσο αριθμό ανθράκων.
Οι λειτουργίες οξυγόνου χαρακτηρίζονται από την εμφάνιση ομάδων υδροξυλίου, καρβονυλίου ή καρβοξυλίου. ΕΝΑ Η παρουσία του ατόμου οξυγόνου αυξάνει τον πολικό χαρακτήρα ενώσεις, καθιστώντας τις πιο υδρόφιλες, αυξάνοντας δηλαδή τη συγγένειά τους για νερό.
Εμφάνιση λειτουργιών οξυγόνου ευθύνεται και για το είδος του διαμοριακή δύναμηπου δρα μεταξύ μορίων. Η φύση και η ένταση των διαμοριακών δυνάμεων επηρεάζουν την διαλυτότητα και τις θερμοκρασίες τήξης και βρασμού.
Ο παρακάτω πίνακας φέρνει μια σύγκριση μεταξύ ορισμένων ιδιοτήτων τριών ενώσεων που έχουν τον ίδιο αριθμό ατόμων άνθρακα, αλλά διαφέρουν από την παρουσία οξυγονωμένων λειτουργικών ομάδων.
Βιολογικό κομπόστ | |||
Βουτάνιο (C4H10) |
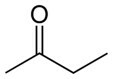
Βουτανόνη (C4H8Ο) |
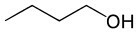
Βουτανόλη (C4H10Ο) |
|
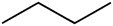 |
 |
 |
|
οργανική λειτουργία |
Υδρογονάνθραξ |
κετόνη (λειτουργία οξυγόνου) |
Αλκοόλ (λειτουργία οξυγόνου) |
Πόλωση |
άπολαρ |
Πολικός |
Πολικός |
θερμοκρασία τήξης |
-138,3°C |
-86°C |
-89°C |
θερμοκρασία βρασμού |
-0,5°C |
80°C |
118°C |
Κυρίαρχη διαμοριακή δύναμη |
Επαγόμενο δίπολο |
μόνιμο δίπολο |
δεσμούς υδρογόνου |
Αλκοόλ
Η οργανική λειτουργία αλκοόλ έχει μια ομάδα υδροξυλίου (-ΟΗ) συνδεδεμένη απευθείας με κορεσμένο άνθρακα, δηλαδή εκείνο το άτομο άνθρακα που δημιουργεί μόνο απλούς δεσμούς.
Λειτουργική ομάδα αλκοολών: R-OH (υδροξυλ).
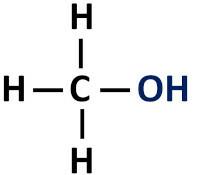
οι αλκοόλες είναι ταξινομούνται ανάλογα με τον τύπο του άνθρακα στον οποίο είναι συνδεδεμένο το υδροξύλιο. Οι πρωτογενείς αλκοόλες έχουν το υδροξύλιο συνδεδεμένο με τον πρωτογενή άνθρακα. Οι δευτεροταγείς αλκοόλες έχουν την υδροξυλομάδα συνδεδεμένη με έναν δευτεροταγή άνθρακα και οι τριτοταγείς αλκοόλες έχουν την ομάδα -ΟΗ τους συνδεδεμένη με τους τριτοταγείς άνθρακες.
Μια οργανική ένωση που έχει μόνο ένα υδροξύλιο ονομάζεται μονοαλκοόλη. Εάν έχει δύο ομάδες υδροξυλίου, ονομάζεται διαλκοόλη. Πάνω από αυτό, τα μόρια ονομάζονται πολυαλκοόλες.
ΕΝΑ ονοματολογία για τις αλκοόλες ακολουθεί τη σύσταση της Iupac (Διεθνής Ένωση Καθαρής και Εφαρμοσμένης Χημείας), εξετάζοντας τη συναρμολόγηση του ονόματος των χημικών δομών σε τρία μέρη:
Πρόθεμα – σχετίζεται με τον αριθμό των ανθράκων.
Infix – αναφέρεται στον τύπο του χημικού δεσμού που δημιουργείται μεταξύ των ατόμων άνθρακα.
Επίθημα – που σχετίζεται με τη λειτουργική ομάδα. Στην περίπτωση των αλκοολών, το επίθημα που χρησιμοποιείται είναι -Γειά σου.
Δείτε παραδείγματα:
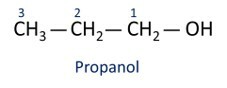
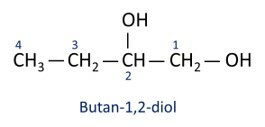
Ο κύριο αλκοόλ είναι αιθάνιομεγάλο (CH3CH2OH), χρησιμοποιείται ως καύσιμο, σε αλκοολούχα ποτά, ως χημικός διαλύτης, καθαριστικό και απολυμαντικό.
κετόνη
Η συνάρτηση οργανικής κετόνης αντιστοιχεί στην καρβονυλική λειτουργική ομάδα (C=O), που βρίσκεται μεταξύ δύο ατόμων άνθρακα της αλυσίδας άνθρακα.
Λειτουργική ομάδα κετονών: R1–(C=O)–R2.

Οι κετόνες είναι ταξινομούνται ανάλογα με τον αριθμό των καρβονυλικών ομάδων:
Μονοκετόνες - έχουν μια ενιαία καρβονυλική ομάδα.
Οι δικετόνες - έχουν δύο καρβονυλικές ομάδες.
Οι πολυτόνοι - έχουν περισσότερες από δύο καρβονυλικές ομάδες.
ΕΝΑ ονοματολογία για τις κετόνες ακολουθεί τους κανόνες Iupac, αλλά με διαφορά στην ορθογραφία της κατάληξης. Οι κετόνες προσδιορίζονται από το επίθημα -πάνω σε.
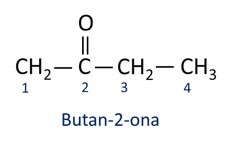
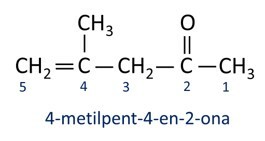
Γενικά, οι κετόνες βρίσκουν εφαρμογή στην παρασκευή άλλων χημικών και φαρμακευτικών προϊόντων. Στη βιομηχανία, οι κετόνες χρησιμοποιούνται ως διαλύτες για χρώματα, βαφές και βερνίκια. Μία από τις πιο γνωστές κετόνες είναι προπανόνη, το οποίο είναι ευρέως γνωστό ως ακετόνη. Τα διαλύματα ακετόνης χρησιμοποιούνται για την αφαίρεση βερνικιού νυχιών.
Διαβάστε επίσης:Αμίδια — ενώσεις που έχουν άζωτο συνδεδεμένο με το καρβονύλιο
Αλδεγύδη
Η οργανική συνάρτηση αλδεΰδης είναι χαρακτηρίζεται από την παρουσία της καρβονυλικής λειτουργικής ομάδας, του οποίου το άτομο άνθρακα έχει δεσμό υδρογόνου.
Λειτουργική ομάδα αλδεΰδων: H–C=O (φορμύλιο).
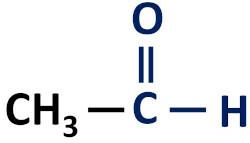
Οι αλδεΰδες εμφανίζονται πάντα στο τέλος των αλυσίδων άνθρακα επειδή το άτομο άνθρακα τους πρέπει να συνδεθεί με τουλάχιστον ένα άτομο υδρογόνου.
ΕΝΑ ονοματολογία για ενώσεις αλδεΰδης ακολουθεί τους κανόνες της IUPAC, που διαφέρουν από το επίθημα. Οι αλδεΰδες προσδιορίζονται με το επίθημα -al.
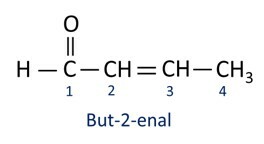
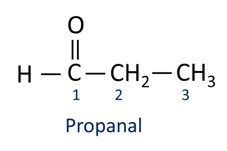
Οι αλδεΰδες χρησιμοποιούνται βιομηχανικά στην παρασκευή αρωμάτων και άρωμα, καθώς η μυρωδιά και η γεύση του ποικίλλουν ανάλογα με το μήκος της ανθρακικής αλυσίδας. Οι ενώσεις αλδεΰδης χρησιμοποιούνται επίσης στην κατασκευή προϊόντων καθαρισμού, φαρμάκων, πολυμερών, μεταξύ άλλων. Οι αλδεΰδες βραχείας αλυσίδας άνθρακα μπορούν να χρησιμοποιηθούν ως παράγοντας διατήρησης, όπως οι περίφημες φορμαλίνη, η οποία είναι μια αλδεΰδη που ονομάζεται μεθανάλη.

καρβοξυλικό οξύ
Η λειτουργία του οργανικού καρβοξυλικού οξέος προσδιορίζεται από την παρουσία της καρβοξυλικής λειτουργικής ομάδας (-COOH).
Λειτουργική ομάδα καρβοξυλικών οξέων: –(C=O)OH ή –COOH.

Οι ενώσεις που ανήκουν σε αυτή την οργανική λειτουργία είναι αδύναμα οξέα, καθώς απελευθερώνουν εύκολα ιόντα Η+ σε υδατικό διάλυμα.
ΕΝΑ ονοματολογία για καρβοξυλικά οξέα ακολουθεί τους κανόνες του Iupac, ωστόσο ο όρος "οξύ" εμφανίζεται πριν από το πρόθεμα που υποδηλώνει τον αριθμό άνθρακα και το επίθημα που χρησιμοποιείται είναι -oic.
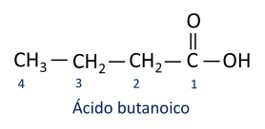
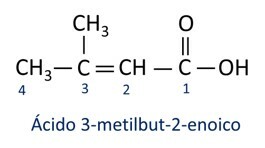
Ο Το πιο κοινό καρβοξυλικό οξύ στην καθημερινή ζωή είναι το Οξικό οξύ, ουσία που υπάρχει στο ξύδι. Η βιταμίνη C, άφθονη σε πολλά εσπεριδοειδή, είναι ένα οργανικό μόριο που ονομάζεται ασκορβικό οξύ.
Αστήρ
Η λειτουργία του οργανικού εστέρα αναγνωρίζεται από την παρουσία της καρβονυλικής λειτουργικής ομάδας, του οποίου το άτομο άνθρακα έχει ένα πρόσδεμα οξυγόνου.
Λειτουργική ομάδα εστέρων: –R–(C=O)O–R'.
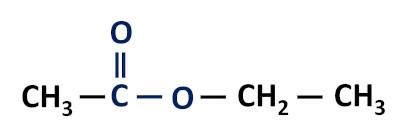
Οι εστέρες είναι παράγωγα καρβοξυλικών οξέων, που διαφέρουν από αυτά στο ότι έχουν μια ρίζα αλκυλίου συνδεδεμένη με το άτομο οξυγόνου αντί για το άτομο υδρογόνου.
Τα μόρια που ανήκουν στην εστερική συνάρτηση σχηματίζονται από την αντίδραση μεταξύ ενός καρβοξυλικού οξέος και μιας αλκοόλης, μια αντίδραση γνωστή ως εστεροποίηση.
Οι κανόνες για ονοματολογία εστέρων ορίζεται από τον Iupac θεωρείτε ότι το μόριο σχηματίζεται από δύο μέρη:
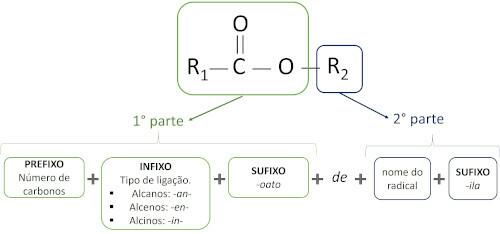
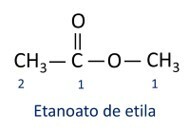
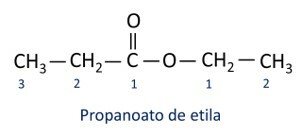
Το κύριο χαρακτηριστικό των εστέρων είναι ικανότητα προσομοίωσης γεύσης και αρώματος των φυσικών τροφίμων, ανάλογα με το μήκος των αλυσίδων άνθρακα (R1 και Ρ2). Εξαιτίας αυτού, οι εστέρες χρησιμοποιούνται ευρέως ως αρωματικοί παράγοντες στη βιομηχανία τροφίμων, στην παραγωγή φαρμακευτικών προϊόντων, αρωμάτων και καλλυντικών.
Αιθέρας
Η οργανική λειτουργία του αιθέρα είναι χαρακτηρίζεται από το ότι έχει ένα άτομο οξυγόνου μεταξύ δύο αλυσίδων άνθρακα.
Λειτουργική ομάδα αιθέρων: R–O–R.

Οι αιθέρες είναι πολύ εύφλεκτες ουσίες, με χαρακτηριστική και έντονη οσμή.
ΕΝΑ επίσημη ονοματολογία Iupac για τους αιθέρες ακολουθεί τη σειρά πρόθεμα + επίθεμα + επίθημα. Ωστόσο, στην πλευρά του μορίου που έχει λιγότερους άνθρακες δίνεται το επίθημα -οξυ ενώ η μακρύτερη ανθρακική αλυσίδα ονομάζεται σαν να ήταν υδρογονάνθρακας, λαμβάνοντας το επίθημα -ο.
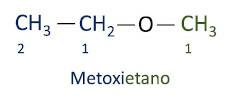
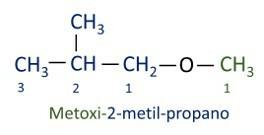
Οι αιθέρες είναι χρησιμοποιείται ως διαλύτης για χρώματα, ρητίνες, λάδια και λίπη. Ως αποτέλεσμα, χρησιμοποιούνται σε διάφορες βιομηχανικές και φαρμακευτικές διεργασίες. Ο αιθέρας χρησιμοποιήθηκε κάποτε ως αναισθητικό, που αντικαταστάθηκε από άλλες ασφαλέστερες ουσίες αυτές τις μέρες.
Διαβάστε επίσης:Νιτροενώσεις — ενώσεις που περιέχουν ομάδες νίτρο (NO2) στο μόριό τους
Λυμένες ασκήσεις για τις λειτουργίες οξυγόνου
ερώτηση 1
(Uece) Στην Οργανική Χημεία, μια λειτουργική ομάδα ορίζεται ως μια μοριακή δομή που δίνει στις ουσίες παρόμοια χημική συμπεριφορά. Το σύνολο των ενώσεων που έχουν την ίδια λειτουργική ομάδα ονομάζεται οργανική λειτουργία. Σημειώστε την επιλογή που παρουσιάζει σωστά την ένωση και την οργανική συνάρτηση στην οποία ανήκει.

Ανάλυση:
Γράμμα Γ
Μεταξύ των εναλλακτικών, η μόνη που εκφράζει σωστά τη λειτουργική ομάδα στο όνομα της χημικής συνάρτησης είναι το στοιχείο C. Η συνάρτηση οργανικού εστέρα ορίζεται από την καρβονυλική λειτουργική ομάδα, της οποίας το άτομο άνθρακα έχει επίσης έναν συνδέτη οξυγόνου.
Στο στοιχείο Α, εκφράζεται η λειτουργική ομάδα αιθέρα.
Στο στοιχείο Β, εκφράζεται η λειτουργική ομάδα κετόνης.
Στο στοιχείο Δ εκφράζεται η χαρακτηριστική ομάδα αμιδίου. αμίνες είναι αμίδια ανήκουν στις λειτουργίες του αζώτου.
Ερώτηση 2
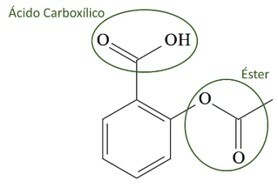
(UCS-RS) Τον 5ο αιώνα π.Χ. Ο Γ., Ιπποκράτης, Έλληνας γιατρός, έγραψε ότι ένα προϊόν φλοιού ιτιάς ανακούφισε από τον πόνο και μείωσε τον πυρετό. Το ίδιο αυτό προϊόν, μια όξινη σκόνη, αναφέρεται ακόμη και σε κείμενα από τους αρχαίους πολιτισμούς της Μέσης Ανατολής, των Σουμερίων, της Αιγύπτου και της Ασσυρίας. Οι ιθαγενείς της Αμερικής το χρησιμοποιούσαν επίσης κατά των πονοκεφάλων, του πυρετού, των ρευματισμών και του τρόμου. Αυτό το φάρμακο είναι πρόδρομος της ασπιρίνης, η χημική δομή της οποίας φαίνεται παρακάτω.
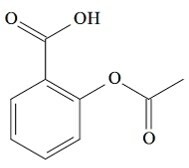
Οι οργανικές λειτουργίες που υπάρχουν στη δομή της ασπιρίνης, που αναπαριστώνται παραπάνω, είναι:
α) καρβοξυλικό οξύ και εστέρας.
β) αλκοόλ και αιθέρας.
γ) αμίνη και αμίδιο.
δ) αμίνη και αιθέρας.
ε) αμινοξύ και αλκοόλη.
Ανάλυση:
Γράμμα Α
Της Ana Luiza Lorenzen Lima
Καθηγητής Χημείας
Πηγή: Σχολείο Βραζιλίας - https://brasilescola.uol.com.br/quimica/funcoes-oxigenadas.htm

