Ο χρώμιο, ατομικός αριθμός 24, είναι ένα μεταβατικό μέταλλο που βρίσκεται στην ομάδα 6 του Περιοδικού Πίνακα. Το χρώμα του είναι γκριζωπό, αλλά είναι επίσης ένα πολύ γυαλιστερό μέταλλο. Υπάρχει κυρίως σε καταστάσεις οξείδωσης +2, +3 και +6 και έχει το χαρακτηριστικό ότι όλες οι ενώσεις του είναι έγχρωμες. Δεν είναι περίεργο που το όνομά του προέρχεται από τα ελληνικά χρωμα, που σημαίνει χρώμα.
Το στοιχείο αυτό λαμβάνεται μέσω του χρωμίτη και χρησιμοποιείται ευρέως στη μεταλλουργική βιομηχανία, στην παραγωγή ανοξείδωτου χάλυβα και άλλων ειδικών κραμάτων. Το χρώμιο μπορεί επίσης να επιμεταλλωθεί με ηλεκτρολυτική επίστρωση σε αντικείμενα, με ένα εφέ γνωστό ως επιχρωμίωση, το οποίο εγγυάται, εκτός από την ομορφιά, και μεγάλη χημική αντοχή. Οι ενώσεις χρωμίου χρησιμοποιούνται επίσης σε χρωστικές και βαφές, εκτός από πυρίμαχα υλικά.
Διαβάστε επίσης: Άφνιο — το μέταλλο μετάπτωσης που έχει ιδιότητες παρόμοιες με το ζιρκόνιο
περίληψη χρωμίου
Το χρώμιο είναι ένα γκριζωπό, γυαλιστερό μέταλλο που ανοίγει την ομάδα 6 του Περιοδικός Πίνακας.
Είναι πολύ ανθεκτικό στη διάβρωση και τη χημική προσβολή σε θερμοκρασία δωματίου.
Παρουσιάζει κυρίως καταστάσεις οξείδωσης +2, +3 και +6.
Όλες οι ενώσεις του έχουν χρώμα.
Μπορεί να ληφθεί από χρωμίτη, FeCr2Ο4.
Το εκμεταλλεύεται κυρίως η μεταλλουργική βιομηχανία, η οποία το χρησιμοποιεί στην κατασκευή του ανοξείδωτο ατσάλι.
Ανακαλύφθηκε το 1797 από τον Γάλλο Louis Nicolas Vauquelin.
[pullicity_omnia]
ιδιότητες χρωμίου
Σύμβολο: Cr.
Ατομικός αριθμός: 24.
Ατομική μάζα: 51,9961 κ.ε.
Ηλεκτραρνητικότητα: 1,66.
Σημείο σύντηξης: 1907°C.
Σημείο βρασμού: 2671°C.
Πυκνότητα: 7,15 γρ.εκ-3 (στους 20°C).
Ηλεκτρονική διαμόρφωση: [Αέρας] 4 δευτ1 3d5.
Χημική Σειρά: ομάδα 6, Μetais μετάβαση.
χαρακτηριστικά χρωμίου
Το χρώμιο, ατομικός αριθμός 24, είναι α μέταλλο γκρι χρώμα, σκληρό και γυαλιστερό. Σε θερμοκρασία δωματίου, αντέχει καλά σε χημικές επιθέσεις, όπως από όξινα ή βασικά διαλύματα, με εξαίρεση το HCl και το H2ΜΟΝΟ4 αραιωμένο. Ωστόσο, σε υψηλότερες θερμοκρασίες, το χρώμιο γίνεται πολύ πιο αντιδραστικό και οξειδώνεται εύκολα από το Ο2, και συνδυάζεται με αλογόνα και τα περισσότερα αμέταλλα.
Σε διάλυμα, οι ενώσεις χρωμίου τείνουν να έχουν αριθμούς οξείδωσης +6, +3 και +2. Στην πραγματικότητα, ένα ενδιαφέρον χαρακτηριστικό είναι ότι όλα τις ενώσεις χρωμίου είναι χρωματιστά, όπως το διχρωμικό του κάλιο, Κ2Cr2Ο7, που είναι πορτοκαλί, και χρωμικό κάλιο, Κ2CrO4, που είναι κίτρινο.
Ένα περίεργο γεγονός για το χρώμιο είναι αυτό η ηλεκτρονιακή του διαμόρφωση δεν ακολουθεί το αναμενόμενο πρότυπο. κάνοντας σας ηλεκτρονική διανομή, θα αναμενόταν να είναι [Ar] 4s2 3d4, ωστόσο, οι υπολογισμοί ενέργειας και σταθερότητας δείχνουν ότι η διαμόρφωση [Ar] 4s1 3d5 είναι πιο σταθερό. Αυτό μπορεί να εξηγηθεί από το Ο κανόνας του Hund.
Σύμφωνα με αυτόν τον κανόνα, τόσο μεγαλύτερος είναι ο αριθμός των ηλεκτρόνια με ίσα (ή παράλληλα) σπιν σε ένα ημιτελές τροχιακό, τόσο χαμηλότερη είναι η ενέργεια του άτομο, δηλαδή τόσο μεγαλύτερη είναι η σταθερότητα. Δείτε την παρακάτω εικόνα:
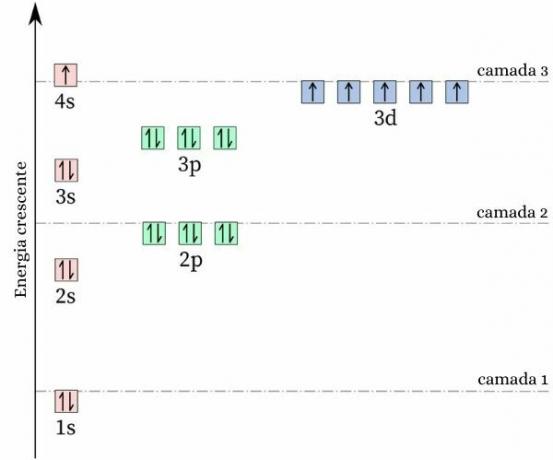
Εάν το chrome υιοθέτησε τη διαμόρφωση 4s2 3d4, το τροχιακό 4s θα παρουσίαζε ηλεκτρόνια με αντίθετο σπιν (↑↓), το οποίο θα αύξανε την απώθηση, σε τελική ανάλυση, θα υπήρχαν δύο φορτία του ίδιου σημείου που μοιράζονται ένα μόνο τροχιακό.
Υιοθετώντας τη διαμόρφωση 4s1 3d5, το χρώμιο κρατά μεγαλύτερο αριθμό ηλεκτρονίων με ίσο σπιν, χωρίς την παρουσία ηλεκτρονίων που μοιράζονται το ίδιο τροχιακό (όπως φαίνεται στην προηγούμενη εικόνα), γεγονός που μειώνει την ενέργειά του και εγγυάται μεγαλύτερη σταθερότητα.
Δείτε επίσης: Βανάδιο — χημικό στοιχείο του οποίου τα διαλύματα έχουν επίσης διαφορετικά χρώματα
Πού μπορεί να βρεθεί το χρώμιο;
το χρώμιο είναι το δέκατο πιο άφθονο στοιχείο στη γη. Αν και υπάρχουν αρκετά ορυκτά που έχουν χρώμιο στη σύστασή τους, χρωμίτη, FeCr2Ο4, είναι το σημαντικότερο ορυκτό του χρωμίου, όντας το πιο ευρέως αξιοποιημένο εμπορικά.

Είναι σημαντικό να τονιστεί ότι η χώρες με τα υψηλότερα αποθέματα χρωμίου είναι:
Νότια Αφρική;
Καζακστάν;
Ινδία;
Τουρκία.
Ο Βραζιλία είναι ο μόνος παραγωγός χρωμίου σε ολόκληρη την αμερικανική ήπειρο, αλλά κατέχει μόνο το 0,11% των παγκόσμιων αποθεμάτων. Τα αποθεματικά κατανέμονται κυρίως στις ακόλουθες πολιτείες:
Μπαΐα;
αμάπα;
Minas Gerais.
Παίρνοντας το χρώμιο

Ο παράγεται μεταλλικό χρώμιο διά μέσου από χρωμίτη. Σε αυτή την περίπτωση, το ορυκτό λιώνει με ανθρακικό νάτριο, Στο2CO3, παρουσία αέρα, που παράγει χρωμικό νάτριο και οξείδιο σιδήρου III:
4 FeCr2Ο4 + 8 ίντσες2CO3 + 7 Ο2 → 8 ίντσες2CrO4 + 2 Fe2Ο3 + 8 CO2
Από εκεί, η εξαγωγή πραγματοποιείται με Νερό, αφού το Να2CrO4 είναι διαλυτό στο νερό, ενώ ο Fe2Ο3 δεν. Στη συνέχεια, το μέσο οξινίζεται με Η2ΜΟΝΟ4, που επιτρέπει την κρυστάλλωση του χρωμικού του νάτριο. μετά ένα2CrO4 ανάγεται σε οξείδιο του χρωμίου III με τη χρήση του άνθρακας σε υψηλή θερμοκρασία:
Στο2CrO4 + 2 C → Cr2Ο3 + επάνω2CO3 + CO
Το μεταλλικό χρώμιο λαμβάνεται στη συνέχεια όταν το αλουμίνιο χρησιμοποιείται ως αναγωγικός παράγοντας, επίσης σε υψηλή θερμοκρασία:
Cr2Ο3 + 2 Αλ → Αλ2Ο3 + 2 Cr
εφαρμογές χρωμίου
Ο βιομηχανία μεταλλουργική είναι ο κύριος καταναλωτής χρωμίου, με περίπου το 80% του συνόλου του παραγόμενου χρωμίου, είτε σε μορφή χρωμίτη είτε σε συμπύκνωμα Cr.2Ο3. Αυτό συμβαίνει επειδή το χρώμιο είναι ικανό να σχηματίσει το κράμα σιδηροχρωμίου, τη βασική πηγή για τη λήψη ανοξείδωτο χάλυβα και άλλα ειδικά κράματα.
Το χρώμιο, το οποίο συνήθως αποτελεί το 18% του ανοξείδωτου χάλυβα, αυξάνει σημαντικά την αντίσταση στην οξείδωση (διάβρωση) και σε άλλες χημικές επιθέσεις στον χάλυβα. Σε άλλα ειδικά κράματα, το χρώμιο παίζει επίσης ρόλο στην αύξηση της σκληρότητας, της σκληρότητας και της σκληρότητας των υλικών.

Ο πυρίμαχη βιομηχανία Είναι επίσης καλός καταναλωτής χρωμίου, καθώς ο χρωμίτης είναι ένα πολύ γνωστό πυρίμαχο υλικό, δηλαδή ένα υλικό ικανό να αντέχει τις θερμικές, χημικές και φυσικές επιπτώσεις που εμφανίζονται στις βιομηχανίες. Ο χρωμίτης, που χρησιμοποιείται για την κατασκευή πυρίμαχων τούβλων, είναι πολύ ανθεκτικός στην υποβάθμιση όταν εκτίθεται σε θέρμανση.
ήδη το χημική βιομηχανία επιδιώκει να χρησιμοποιήσει το χρώμιο με διάφορους τρόπους:
ως καταλύτης?
ως αναστολέας διάβρωσης.
σε επιχρωμίωση?
σε χρωστικές?
σε ενώσεις βαφής.
Η επιχρωμίωση είναι γνωστή, η οποία αποτελείται από το σχηματισμό ενός προστατευτικού στρώματος χρωμίου πάνω από ένα αντικείμενο, προστατεύοντάς το από τη διάβρωση. Σε αυτή τη διαδικασία, το χρώμιο εναποτίθεται στο αντικείμενο που πρόκειται να χρωμιωθεί ηλεκτρόλυση θειικό χρώμιο III, Cr2(ΜΟΝΟ4)3, που παράγεται από τη διάλυση του Cr2Ο3 στο Χ2ΜΟΝΟ4.
Οι χρωστικές του χρωμίου είναι πολύ κοινές, ειδικά με τα διαφορετικά χρώματα που μπορούν να ληφθούν με τις ενώσεις τους. Στη διάλυση εξαένυδρου χλωριούχου χρωμίου III, CrCl3·6 πμ2Ο, λαμβάνεται ένα ιώδες διάλυμα. Από την άλλη πλευρά, στη διάλυση του θειικού χρωμίου III, το Cr2(ΜΟΝΟ4)3, αποκτάται πράσινο χρώμα.
Το διάλυμα του χλωριούχου χρωμίου II, CrCl2, είναι μπλε, ενώ το οξικό χρώμιο II, Cr2(ΕΡΩΤΟΛΟΓΩ)4, είναι ένα κόκκινο στερεό. Οξείδιο χρωμίου II, CrO2, είναι μαύρο; χρωμικό κάλιο, Κ2CrO4, και κίτρινο? διχρωμικό κάλιο, Κ2Cr2Ο7, και πορτοκαλί? τριχρωμικό κάλιο, Κ2Cr3Ο10, είναι κόκκινο; και οξείδιο του χρωμίου VI, CrO3, είναι επίσης κόκκινο.
Ενδιαφέρων:Τα ρουμπίνια είναι στην πραγματικότητα πολύτιμοι λίθοι, τύπου Al2Ο3, που έχουν ίχνη χρωμίου στη σύστασή τους. Αυτό συμβαίνει και με το σμαράγδι, μια μορφή βηρυλίου, του οποίου το πράσινο χρώμα είναι αποτέλεσμα μικρών ποσοτήτων χρωμίου.
Επίσης γνωρίζω:Βολφράμιο — ένα γκριζωπό μέταλλο του οποίου το χρώμα μοιάζει με ατσάλι
Η σχέση του χρωμίου με την υγεία
Δύο καταστάσεις οξείδωσης του χρωμίου έχουν βιολογικό ρόλο. Ας δούμε στη συνέχεια.
→ Εξασθενές χρώμιο (Cr6+)
Όσον αφορά τον Κρ6+, είναι γνωστό ότι μπορεί να είναι θεωρείται καρκινογόνος, ιδιαίτερα εάν εισπνευστεί ή καταποθεί σε μεγάλες ποσότητες.
→ Τρισθενές χρώμιο (Κρ3+)
Το τρισθενές χρώμιο ήταν πάντα λαμβάνονται υπόψη ουσιαστικό στοιχείο. Τα συμπληρώματα διατροφής του χρωμίου σε αυτή τη μορφή έχουν γίνει δημοφιλή για την προώθηση βασικών ιχνοστοιχείων και ως παράγοντα απώλειας βάρους. Υπάρχει επίσης μια συζήτηση ότι η χορήγηση τρισθενούς χρωμίου θα ήταν ενδιαφέρουσα για τη θεραπεία του διαβήτης τύπου 2, καθώς και για τον διαβήτη κύησης.
Παρόλο, θέτουν ορισμένοι συγγραφείς αυτή η ουσιαστικότητα υπό συζήτηση. Η γραμμή σκέψης είναι ότι το χρώμιο, είτε συμπληρωμένο είτε όχι, δεν κάνει καμία διαφορά στη σύνθεση του σώματος. μεταβολισμός δίνει γλυκόζη ή ευαισθησία στην ινσουλίνη. Πιστεύεται ότι, στην πραγματικότητα, η υψηλότερη δόση χρωμίου έχει φαρμακολογικές και μη θρεπτικές επιδράσεις που το υποδηλώνουν ως βασικό στοιχείο.
ιστορία του χρωμίου
Το όνομα χρώμιο προέρχεται από τα ελληνικά χρωμα, που σημαίνει χρώμα. Έχοντας δώσει επίσης το όνομα σε αυτό το στοιχείο, προέκυψε η ανακάλυψή τουΟ Γάλλος φαρμακοποιός και χημικός Louis Nicolas Vauquelin, το έτος 1797, όταν παρατήρησε το χρώμιο κατά τη μελέτη του μεταλλεύματος κροκοΐτη, PbCrO4. Ωστόσο, αρχικά, το μέταλλο δεν είχε τεράστια εμπορική επιτυχία.
Δεκαπέντε χρόνια μετά την ανακάλυψή του, για παράδειγμα, ο Sir Humphry Davy δεν γνώριζε πολλά για το χρώμιο και τις ενώσεις του όταν έγραψε το διάσημο βιβλίο του Στοιχεία Χημικής Φιλοσοφίας, υποδεικνύοντας μόνο ότι το χρωμικό οξύ είχε ξινή γεύση.
Την ίδια χρονιά, ο Jöns Jacob Berzelius έγραψε ότι η επίγευση του τοξικού χρωμικού οξέος ήταν δυσάρεστη και μεταλλική. Ο Berzelius συνειδητοποίησε ότι το μέταλλο, αν και εύθραυστο, ήταν αρκετά ανθεκτικό στη δράση του οξέα και τον ατμοσφαιρικό αέρα.
Αν και αρχικά δεν είχε τεράστια εμπορική επιτυχία, στα τέλη του 19ου αιώνα και στις αρχές του 20ου αιώνα, το στοιχείο άρχισε να χρησιμοποιείται εμπορικά, καθώς άρχισε να χρησιμοποιείται ευρέως ο ανοξείδωτος χάλυβας, καθώς και η επιχρωμίωση εξαρτημάτων στην αυτοκινητοβιομηχανία, καθιστώντας το χρώμιο μέταλλο με μεγάλη ζήτηση.
Ασκήσεις επίλυσης χρωμίου
ερώτηση 1
(UEFS/BA)Το άτομο του χρωμίου έχει αριθμό οξείδωσης +3 στο είδος
Α) Κρ2Ο3
Β) CrO
Γ) Κρ
Δ) CrO42-
Ε) Κρ2Ο72-
Ανάλυση:
Εναλλακτική Α
Στο γράμμα C, το χρώμιο εμφανίζεται ως απλή ουσία, οπότε, στην περίπτωση αυτή, το NOx ισούται με μηδέν.
Ο οξυγόνο στις άλλες ενώσεις εμφανίζεται με NOx ίσο με -2. Έτσι, μπορούμε να υπολογίσουμε τα NOx του χρωμίου σε όλα τα είδη, καθιστώντας το άγνωστο (x):
Cr2Ο3 → 2x + 3(-2) = 0 ⸫ x = +3
CrO → x + (-2) = 0 ⸫ x = +2
CrO42- → x + 4(-2) = -2 ⸫ x = +6
Cr2O72- → 2x + 7(-2) = -2 ⸫ x = +6
Ερώτηση 2
(UPE 2013) Μια διεθνής ομάδα επιστημόνων ανακάλυψε μια πολύπλοκη χημική αντίδραση που είναι υπεύθυνη για την επιδείνωση ορισμένων από τα σπουδαία έργα τέχνης στην ιστορία, παραγωγή του Vincent van Gogh (1853–1890) και άλλων διάσημων ζωγράφων του 20ου αιώνα XIX. Στις έρευνές τους, αυτοί οι ερευνητές γήρανσαν τεχνητά τις χρωστικές και διαπίστωσαν ότι η το σκουρόχρωμο του άνω στρώματος σχετιζόταν με μια αλλαγή του χρωμίου που υπάρχει στο χρώμα από Cr(VI) σε Cr(III).
Διαθέσιμο σε: http://agencia.fapesp.br/13455 (Προσαρμοσμένο)
Δεδομένα:Cr (Z = 24), ηλεκτρονική διαμόρφωση: [Ar] 4s1 3d5
Λαμβάνοντας υπόψη την κατάσταση που περιγράφεται παραπάνω, είναι ΣΩΣΤΟΣισχυρίζονται ότι (το)
Α) η οξείδωση του Cr(VI) σε Cr(III) έχει υποβαθμίσει σπουδαία καλλιτεχνικά έργα στην ιστορία.
Β) η γήρανση των κουφωμάτων σχετίζεται με την ηλεκτρονική διέγερση του Cuο για τον Κρ3+.
Γ) Διαδικασία αναγωγής Cr6+ για τον Κρ3+ έχει συσκοτίσει διάσημα έργα του 19ου αιώνα.
Δ) ο μετασχηματισμός που έχει γίνει έχει οξειδώσει το Cuο, υπεύθυνη για τη λάμψη του αρχικού πίνακα.
Ε) η αλλαγή από Cr(VI) σε Cr(III) είναι μια χημική αντίδραση που συμβαίνει μόνο μετά από πολλά χρόνια.
Ανάλυση:
Εναλλακτική Γ
Η μετάβαση από το Cr(VI) στο Cr(III) είναι μια διαδικασία του μείωση (μείωση των NOx), η οποία ευθύνεται για το σκοτάδι των οθονών.
Του Stefano Araújo Novais
Καθηγητής Χημείας

