Ηλεκτρόλυση Πρόκειται για μια μη αυθόρμητη διαδικασία, δηλαδή, που δεν συμβαίνει φυσικά, στην οποία οι ουσίες σχηματίζονται μέσω ηλεκτρικής εκκένωσης σε ενώσεις που τήκονται ή διαλύονται σε νερό. Σε αυτήν τη διαδικασία, ένα ηλεκτρικό ρεύμα φτάνει σε ένα γυάλινο δοχείο (ηλεκτρολυτική δεξαμενή) που έχει δύο αδρανή ηλεκτρόδια (τα οποία δεν υποφέρουν ή οξείδωση ούτε μείωση) σχηματίζεται από γραφίτη ή πλατίνα. Αυτά τα ηλεκτρόδια συνδέονται με μια ηλεκτρική πηγή (συνήθως α τύμπανα) και βυθίζεται σε αλάτι ή βάση λιωμένο ή διαλύεται σε νερό. Ακριβώς όπως το μπαταρία, η ηλεκτρόλυση έχει κάθοδο (όπου συμβαίνει αναγωγή) και άνοδο (όπου συμβαίνει οξείδωση).
Περίληψη
Η ηλεκτρόλυση είναι μια μη αυθόρμητη διαδικασία.
Μπορούν να σχηματιστούν απλές ή σύνθετες ουσίες.
Μπορεί να συμβεί με τηγμένη διαλυμένη ουσία (πυριτική ηλεκτρόλυση).
Μπορεί να συμβεί με διαλυμένη ουσία σε νερό (υδατική ηλεκτρόλυση).
Ένα κατιόν υφίσταται πάντα μείωση στην κάθοδο.
Ένα ανιόν υφίσταται πάντα οξείδωση στην άνοδο.
Δείτε επίσης:Λήψη αλουμινίου από ηλεκτρόλυση

Τύποι ηλεκτρόλυσης
Είναι μια ηλεκτρόλυση που συμβαίνει όταν πραγματοποιείται ηλεκτρική εκφόρτιση σε λιωμένη ιοντική ένωση. Η ιοντική ένωση σχηματίζεται από έναν ιοντικό δεσμό, όπως α άλας ή α βάση ανόργανος. Όταν μιλάμε για τηγμένη ένωση, με τη σειρά, αναφερόμαστε στην ένωση που πηγαίνει από μια στερεή σε υγρή κατάσταση.
- Παράδειγμα πυριτικής ηλεκτρόλυσης
Όταν πραγματοποιούμε τη σύντηξη χλωριούχου καλίου (KCl), αυτό το αλάτι υποβάλλεται στη διαδικασία διαχωρισμού, απελευθερώνοντας το κατιόν καλίου (Κ+) και το ιωδιούχο ανιόν (l-).

Εξίσωση διάστασης για το χλωριούχο κάλιο
Όταν το ηλεκτρικό ρεύμα φτάσει στο ηλεκτρολυτικό κελί με αυτά τα ιόντα, το κατιόν καλίου μειώνεται, σχηματίζοντας μεταλλικό κάλιο (Κ) και το ανιόν ιωδιούχου οξειδώνεται, σχηματίζοντας στερεό ιώδιο (Ι2).
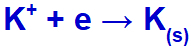
Εξίσωση σχηματισμού στερεού καλίου
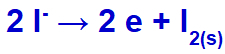
Εξίσωση σχηματισμού στερεού ιωδίου
Είναι μια ηλεκτρόλυση που συμβαίνει όταν η ηλεκτρική εκκένωση πραγματοποιείται σε ένα υδατικό διάλυμα (έχει νερό) που σχηματίζεται από ένα άλας ή μια ανόργανη βάση.
- Παράδειγμα υδατικής ηλεκτρόλυσης
Όταν διαλύουμε το χλωριούχο νάτριο στο νερό, αποσυντίθεται και το νερό υφίσταται ιονισμό:

Εξισώσεις ιονισμού νερού και διαχωρισμού χλωριούχου νατρίου
Ως κατιόν νατρίου (Na+) ανήκει στην οικογένεια ΙΑ, το κατιόν υδρονίου (Η+) διέρχεται από την εκφόρτιση και υφίσταται μείωση, σχηματίζοντας αέριο υδρογόνο (Η2).
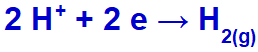
Εξίσωση σχηματισμού αερίου υδρογόνου
Ως χλωρίδιο (Cl-) δεν είναι οξυγονωμένο (δεν έχει οξυγόνο) και δεν είναι φθόριο (F-εκφορτίζεται, οξειδώνεται και σχηματίζει αέριο χλώριο (Cl2).

Εξίσωση σχηματισμού αερίου χλωρίου
Εκλεκτική εκφόρτιση ιόντων
Κατά τη διάρκεια μιας διαδικασίας ηλεκτρόλυσης σε ένα υδατικό μέσο (διάλυμα που σχηματίζεται από νερό και διαλυμένη ουσία), θα έχουμε πάντα δύο κατιόντα: υδρονίου, από νερό και οποιοδήποτε άλλο, από το διαχωρισμός αλατιού (ένα παράδειγμα διαλυμένης ουσίας). Θα έχουμε επίσης δύο ανιόντα: το υδροξύλιο, το οποίο προέρχεται από το νερό, και ένα άλλο, το οποίο προέρχεται από αλάτι.

Ιόντα από ιονισμό νερού και διαχωρισμό άλατος
- Επιλεκτική εκκένωση για κατιόντα και ανιόντα
Εάν το κατιόν από τη διαλυμένη ουσία ανήκει στην οικογένεια IA, IIA ή IIIA, το υδρόνιο (Η+) θα μειωθεί.
Εάν το κατιόν που προέρχεται από τη διαλυμένη ουσία δεν ανήκει στις οικογένειες που αναφέρονται παραπάνω, θα υποστεί τη μείωση.
Εάν το ανιόν από τη διαλυμένη ουσία έχει οξυγόνο στη σύνθεσή του ή είναι φθόριο (F-), το υδροξείδιο (ΟΗ-) θα υποστεί οξείδωση.
Εάν το ανιόν από τη διαλυμένη ουσία δεν έχει τα παραπάνω χαρακτηριστικά, θα υποστεί οξείδωση.
Είναι γνωστό ότι το νερό έχει την ικανότητα αυτο-ιονισμού, παράγοντας ιόντα υδρονίου (Η+) και υδροξείδιο (ΟΗ-, αλλά αυτός ο ιονισμός είναι αρκετά περιορισμένος. Το γεγονός αυτό αποδεικνύεται από την αναποτελεσματικότητα του καθαρού νερού στην αγωγή ηλεκτρικού ρεύματος.
Οπως ηλεκτρόλυση περιλαμβάνει ηλεκτρική εκκένωση, για να εκτελεστεί η ηλεκτρόλυση του νερού, είναι απαραίτητο να διαλυθεί μια διαλυμένη ουσία, το που ευνοεί την εκλεκτική απόρριψη υδρονίου και υδροξειδίου (όπως φαίνεται στο θέμα σχετικά με την απόρριψη εκλεκτικός).
Εάν προσθέσουμε θειικό νάτριο (Na2ΜΟΝΟ4), για παράδειγμα, θα έχουμε τα κατιόντα νατρίου στη μέση (Na+) και υδρονίου (Η+), καθώς και ανιόντα υδροξειδίου (ΟΗ-) και θειικό άλας (SO4-2). Έτσι, όταν το ηλεκτρικό ρεύμα φτάνει στην ηλεκτρολυτική δεξαμενή:
το υδρόνιο θα αποφορτιστεί, μειώνοντας, επειδή το νάτριο ανήκει στην οικογένεια IA.
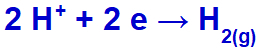
Εξίσωση σχηματισμού αερίου υδρογόνου
Το υδροξείδιο θα υποβληθεί σε εκκένωση, οξειδωτικό, επειδή το θειικό άλας έχει οξυγόνο στη σύνθεσή του.
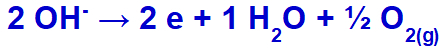
Εξίσωση σχηματισμού αερίων οξυγόνου
Καθώς τα δύο ιόντα (κατιόν και ανιόντα) που προέρχονταν από το νερό εκκενώθηκαν, λέμε ότι πραγματοποιήθηκε η ηλεκτρόλυση του νερού.
Δείτε επίσης: Ποσοτικές πτυχές της ηλεκτρόλυσης
Παραγωγή απλών ουσιών όπως το αέριο υδρογόνο (H2), αέριο οξυγόνο (O2) και τα λοιπά.;
Παραγωγή σύνθετων ουσιών όπως υδροξείδιο του νατρίου (NaOH), θειικό οξύ (Η2ΜΟΝΟ4) και τα λοιπά;
Επικάλυψη εξαρτήματος με ένα συγκεκριμένο μέταλλο, όπως χαλκός (χαλκός) και χρυσός (επιχρυσωμένος)
Χρησιμοποιήστε το για να αφαιρέσετε ένα συγκεκριμένο μέταλλο από το μετάλλευμά σας.
Επιλυμένες ασκήσεις για ηλεκτρόλυση
Παράδειγμα 1 - (Vunesp) Ένα υδατικό διάλυμα CuCℓ2 υποβάλλεται σε ηλεκτρόλυση, χρησιμοποιώντας ηλεκτρόδια πλατίνας. Η σωστή δήλωση είναι:
α) Η μείωση ιόντων Cu συμβαίνει στην κάθοδο2+.
β) Η οξείδωση ιόντων Cu συμβαίνει στην άνοδο2+.
γ) Το αέριο χλώριο σχηματίζεται στην κάθοδο.
δ) Μέρος της ανόδου πλατίνας διαλύεται, σχηματίζοντας Pt2+.
ε) Τα προϊόντα αυτής της ηλεκτρόλυσης θα ήταν διαφορετικά εάν η ηλεκτρόλυση του CuCl2 ήταν φλογερά (fusion).
α) Σωστό. Όταν CuCl2 διαλύεται σε νερό, έχουμε τα κατιόντα υδρονίου (Η+) και χαλκός II (Cu+2). Καθώς το κατιόν χαλκού II δεν ανήκει στις οικογένειες IA, IIA και IIIA, μειώνεται.
β) Ψευδές, καθώς το χλωριούχο ανιόν (Cl) οξειδώνεται στην άνοδο-), το οποίο δεν έχει οξυγόνο στη σύνθεσή του και δεν είναι φθόριο (F-).
γ) Λάθος, επειδή η μείωση του κατιόντος χαλκού II συμβαίνει στην κάθοδο, επομένως, υπάρχει ο σχηματισμός του χαλκού μετάλλου.
δ) Λάθος, καθώς τα ηλεκτρόδια λευκοχρύσου ή γραφίτη στην ηλεκτρόλυση οδηγούν μόνο ηλεκτρισμό, δεν συμμετέχουν στη διαδικασία.
ε) Λάθος, αφού η πυριτική ηλεκτρόλυση χλωριούχου χαλκού II (CuCl2) θα παρουσίαζε ακριβώς τα ίδια προϊόντα με το υδατικό, όπως τα ιόντα που υπάρχουν θα ήταν χαλκός II (Cu+2) και το χλωρίδιο (Cl-1).
Παράδειγμα 2- (UFRN) Εξετάστε τα ακόλουθα συστήματα:
ΕΓΩ. Λειωμένο χλωριούχο νάτριο;
ΙΙ. Υδατικό διάλυμα χλωριούχου νατρίου.
III. Συντηγμένο υδροξείδιο του νατρίου;
IV. Υδατικό διάλυμα υδροξειδίου του νατρίου.
Αυτά που μπορούν να παρέχουν νάτριο, όταν υποβάλλονται σε ηλεκτρόλυση, είναι:
α) μόνο I και II.
β) μόνο I και III.
γ) μόνο II και IV.
δ) μόνο III και IV.
ε) I, II, III και IV.
Τα συστήματα που παρέχουν μεταλλικό νάτριο ως προϊόν στην κάθοδο είναι τα I και III.
I- Το μόνο κατιόν που υπάρχει στο μέσο είναι το κατιόν νατρίου, επομένως, μόνο αυτό μπορεί να μειώσει, σχηματίζοντας μεταλλικό νάτριο.
II- Αυτό το σύστημα δεν παρέχει μεταλλικό νάτριο επειδή το χλωριούχο νάτριο διαλύθηκε σε νερό, έτσι στη μέση έχουμε την παρουσία κατιόντων νατρίου (Na+) και υδρονίου (Η+- αυτός είναι αυτός που υποφέρει από τη μείωση, καθώς το νάτριο ανήκει στην οικογένεια IA.
III - Το μόνο κατιόν που υπάρχει στο μέσο είναι το κατιόν νατρίου (επειδή το υλικό έχει υποστεί σύντηξη), επομένως, μόνο αυτό υφίσταται αναγωγή, σχηματίζοντας μεταλλικό νάτριο.
IV- Αυτό το σύστημα δεν παρέχει μεταλλικό νάτριο επειδή το υδροξείδιο του νατρίου διαλύθηκε σε νερό, έτσι στη μέση έχουμε την παρουσία κατιόντων νατρίου (Na+) και υδρονίου (Η+- αυτός είναι αυτός που υποφέρει από τη μείωση, καθώς το νάτριο ανήκει στην οικογένεια IA.
Από μένα. Diogo Lopes Dias
